 |
Тестовые задания. Выберите один правильный ответ. Показатели ph и poh. Гидролиз солей. Метод нейтрализации. . Общая характеристика метода кислотно-основного титрования (нейтрализации)
|
|
|
|
Тестовые задания
Выберите один правильный ответ
1. 10г сыворотки крови взрослого человека содержат 0. 015 г холестерина
(C27H47O). Массовая доля холестерина равна:
1) 15 % 3) 0. 015%
2) 1. 5 % 4) 0. 15%
2. Сколько мл 5М раствора магнезии (MgSO4) требуется для приготовления
400мл 25% раствора с плотностью ρ =1. 2 г/мл?
1) 100 мл 3) 20. 0 мл
2) 200 мл 4) 25. 0 мл
3. Молярность 0. 5 н. раствора серной кислоты равна:
1) 0. 25 М 3) 1. 00 М
2) 0. 50 М 4) 0. 05 М
4. Концентрация, имеющая размерность [г/мл]:
1) молярная 3) титр
2) моляльная 4) нормальная
5. Масса NaCl, попадающая в организм при введении 400 мл 0. 9%
(физиологического) раствора:
1) 4. 2 г 3) 20. 0 г
2) 3. 6 г 4) 5. 0 г
6. При смешивании 200 г 20% и 300 г 10% растворов борной кислоты
образуется раствор с процентной концентрацией:
1) 18% 3) 16%
2) 15% 4) 14%
7. Какое количество вещества содержится в 500 г растворителя, если
моляльность раствора равна 0. 5 моль/кг:
1) 0. 5моль 3) 0. 25моль
|
|
|
2) 1. 0моль 4) 0. 05моль
8. Сколько мл 0. 1М раствора уксусной кислоты нужно взять для приготовления 200 мл 0. 05М раствора:
1) 50 2) 20 3) 100 4) 5
9. Мольная доля имеет размерность:
1) моль/л 3) г/мл
2) моль/кг 4) это безразмерная величина
10. Растворы по агрегатному состоянию могут быть:
1) только жидкие
2) жидкие и газообразные
3) твердые, жидкие и газообразные
4) жидкие и твердые
11. Нормальность 0. 1М раствора сульфата алюминия:
1) 0. 1н. 2) 0. 6н. 3) 0. 3н. 4) 0. 2н.
12. Мольная доля растворенного вещества равна 0. 05, тогда мольная доля
растворителя составляет:
1) 0. 05 3) 0. 1
2) 0. 95 4) 9. 5
13. Молярность – это число моль растворенного вещества, которое
содержится в:
1) 1 л растворителя 3) 1 кг раствора
2) 1 кг растворителя 4) 1 л раствора
14. Растворы, в которых наблюдается межчастичное взаимодействие,
называются:
1) реальными 3) разбавленными
2) идеальными 4) нет верного ответа
15. Молярная концентрация раствора глюкозы, 1 л которого содержит
18 г вещества (М(глюкозы) = 180 г/моль), равна:
1) 1. 0 моль/л 3) 10. 0 моль/л
2) 0. 1 моль/л 4) 1. 8 моль/л
16. Для приготовления 5л 0. 1н. раствора NaOH (М=40г/моль) требуется
масса вещества, равная:
1) 50 3) 100
|
|
|
2) 20 4) 5
17. Истинный раствор образуется при введении в воду:
1) крахмала 3) бензола
2) сахара 4) аргона
18. Наиболее концентрированный раствор серной кислоты:
1) 1М 3) 1%
2) 1н. 4) все концентрации одинаковы
19. Титр раствора можно найти по формуле:
1) T= mв-ва / mр-ра 3) T=Э·СN/1000
2) T=Э· mв-ва /1000 4) T= mв-ва·V/100
20. Раствор, для которого понятия нормальности и молярности совпадают:
1) К2Сr2О7 3) H2SO4
2) NaCl 4) Ba(OH)2
ПОКАЗАТЕЛИ pH и pOH. ГИДРОЛИЗ СОЛЕЙ.
МЕТОД НЕЙТРАЛИЗАЦИИ.
Вода – очень слабый электролит, диссоциирующий на ионы согласно уравнению: 2Н2О ↔ Н3О+ + ОН- или упрощенно Н2О ↔ Н+ + ОН-
Константа равновесия (диссоциации) для последнего уравнения имеет вид:
Кд = [Н+][ОН-]/ [Н2О] (1)
Так как концентрация молекул воды мало изменяется при диссоциации, величину [Н2О] считают постоянной, которую тоже можно включить в константу: [Н+][ОН-]= Кд ·[Н2О]= Кw =1·10-14 (при 22º С) (2)
Константа Кw называется ионным произведением воды и незначительно меняется при изменении температуры. Таким образом, в чистой воде концентрация образующихся ионов составляет: [Н+]=[ОН-]= 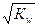 =1·10-7 моль/л. В кислой среде преобладают ионы водорода: [Н+]> [ОН-], в щелочной среде преобладают гидроксильные ионы: [ОН-]> [Н+].
=1·10-7 моль/л. В кислой среде преобладают ионы водорода: [Н+]> [ОН-], в щелочной среде преобладают гидроксильные ионы: [ОН-]> [Н+].
Для количественной характеристики кислотности среды используют водородный показатель рН и гидроксильный показатель рОН (в аналитической химии значок «р» перед искомой величиной всегда означает «-lg» от этой концентрации):
рН = -lg[Н+]; рОН=-lg[ОН-] (3)
Логарифмируя левую и правую часть уравнения (2), получаем:
|
|
|
-lg([Н+]·[ОН-])= -lg10-14 => -lg[Н+]+(-lg [ОН-])= 14 => рН+рОН=14
Таким образом, сумма показателей:
рН+рОН=14 (4)
В кислой среде рН< 7, в нейтральной среде рН=7, в щелочной среде рН> 7.
Общая характеристика метода кислотно-основного титрования (нейтрализации)
Реакция нейтрализации – протолитическое взаимодействие кислоты и основания, в результате которого образуется соль и вода.
НА + ВОН ↔ ВА + Н2О
кисл осн соль
Несмотря на название метода, при смешении стехиометрических количеств кислоты и основания не всегда образуется нейтральная среда в точке эквивалентности (при окончании реакции), что объясняется гидролизом образующейся соли ВА. Возможны следующие случаи:
1) Если ВА образована сильным основанием и сильной кислотой (NaCl, Ba(NO3)2, и т. д. ), соль не подвергается гидролизу, рНт. экв. =7.
В этом случае реакция нейтрализации действительно сводится к взаимодействию Н+ + ОН- → Н2О с образованием нейтральной среды.
2) Если ВА образована сильным основанием и слабой кислотой (K2S, CH3COONa, и т. д. ), соль гидролизуется по аниону, рНт. экв. > 7, среда щелочная.
3) Если ВА образована слабым основанием и сильной кислотой (CuSO4, NH4Cl, и т. д. ), соль гидролизуется по катиону, рНт. экв. < 7, среда кислая.
4) Если ВА образована слабым основанием и слабой кислотой (Al2S3, CH3COONH4, и т. д. ), соль гидролизуется по катиону и аниону, рНт. экв. зависит от относительной силы (констант диссоциации) кислоты и основания, обычно среда близка к нейтральной.
Метод нейтрализации применяется для определения концентрации кислот, щелочей, некоторых солей, оксидов, кислотности биологических жидкостей (желудочный сок, моча, молоко), фармацевтических препаратов, продуктов питания, воды. При этом используется титрование – прибавление одного раствора (из бюретки) к другому (в колбе) по каплям с целью определения эквивалентного объема и вычисления неизвестной концентрации по закону эквивалентов. Если обозначить нормальную концентрацию титруемого раствора С1, а концентрацию титрующего раствора С2, то закон эквивалентов («вещества реагируют в эквивалентных количествах») записывается следующим образом:
|
|
|
С1· V1 = С2· V2 (5),
или Скисл· Vкисл = Сосн· Vосн
Титрованный, или стандартный, раствор – раствор, концентрация которого точно известна. Титрующий раствор часто называют рабочим раствором или титрантом.
В зависимости от титранта различают ацидиметрическое и алкалиметрическое титрование. В методе ацидиметрии в качестве титрантов применяют сильные кислоты. Этим методом определяют сильные и слабые основания, соли слабых кислот и органических соединений, обладающих основными свойствами.
В методе алкалиметрии в качестве титрантов применяют сильные основания. Этим методом определяют сильные и слабые кислоты, соли слабых оснований и органических соединений, обладающих кислыми свойствами.
Основными рабочими растворами в методе кислотно-основного титрования являются чаще всего кислоты HCl и H2SO4 и растворы щелочей NaOH и KOH. Так как эти вещества не удовлетворяют требованиям, предъявляемым к стандартным веществам, из них готовят растворы приблизительной концентрации, которые затем стандартизируют.
В качестве стандартных веществ при установке точной концентрации кислот используют тетраборат натрия (буру) Na2B4O7 ·10H2O или безводный карбонат натрия Na2CO3. Для установки титра щелочей используют щавелевую кислоту H2C2O4 · 2H2O, янтарную кислоту H2C4H4O4, бензойную кислоту C6H5COOH и др.
Так как реакция нейтрализации не сопровождается каким-либо внешним эффектом, точку эквивалентности определяют по изменению окраски индикатора, который добавляют в титруемый раствор (в колбу).
|
|
|


