 |
Кривые титрования. I. Кривая титрования сильной кислоты сильным основанием (и наоборот).. Пример.
|
|
|
|
Кривые титрования
Кривые титрования в методе нейтрализации представляют собой графическое изображение изменения рН раствора в процессе титрования в зависимости от количества добавленного титранта. В зависимости от относительной силы кислот и оснований, участвующих в реакции, различают различные случаи титрования, каждый из которых описывается собственной кривой титрования.
До начала титрования значение рН титруемого раствора определяется концентрацией (для сильных кислот и оснований) и константой диссоциации (для слабых кислот и оснований) титруемого раствора; после точки эквивалентности – концентрацией титранта. В промежуточных точках титрования факторы, определяющие рН титруемого раствора, различны и зависят от того, какое вещество титруют.
Особое значение имеет расчет скачка на кривой титрования. Скачок титрования – это резкое изменение рН вблизи точки эквивалентности. Начало скачка соответствует недостатку в 0, 1 % прибавленного титранта (т. е. добавлено 99, 9 % титрата), а конец скачка соответствует избытку добавленного титранта в количестве 0, 1 %. Скачок титрования – наиболее существенная часть кривой титрования, т. к. именно по нему производят выбор индикатора.
Величина и положение (по шкале pH) скачка титрования зависят от силы титруемой кислоты и основания. Чем больше скачок на кривой титрования, тем меньше погрешность титрования, связанная с выбором индикатора.
I. Кривая титрования сильной кислоты сильным основанием (и наоборот).
При построении кривой титрования сильной кислоты щелочью рН в исходном растворе сильной кислоты определяют по формуле pH = - lg скисл (для одноосновной кислоты), т. к. в результате полной диссоциации скисл = [H+].
|
|
|
До точки эквивалентности в растворе будет присутствовать избыток неоттитрованной сильной кислоты, следовательно, избыток H+-ионов (рН < 7); за точкой эквивалентности в растворе будет находиться избыток щелочи, т. е. избыток [ OH-] - ионов (рН > 7).
В точке эквивалентности в растворе существует соль сильной кислоты и сильного основания, которая не подвергается гидролизу, и среда будет нейтральная (рН = 7).
Для расчета избыточного содержания [H+]-, [OH-] -ионов используют формулы, учитывающие разбавление раствора за счет добавления титранта.
В случае титрования одноосновных кислот получают следующие формулы:
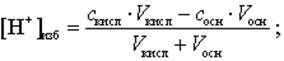 (9)
(9)
pH = - lg[ H+]изб; (10)
 (11)
(11)
pH = 14 - pOH = 14 + lg [OH-]изб (12)
где скисл– нормальная (для одноосновных кислот=молярная) концентрация кислоты, моль/л;
сосн – нормальная (для однокислотных оснований=молярная) концентрация основания, моль/л.
Пример.
Построить кривую титрования 10, 0 мл 0, 1 М HСl раствором 0, 1 М NaOH.
Решение:
Расчет кривой титрования начинается с расчета рН исходного титруемого раствора: рН = - lg 0, 1 = 1, 0.
Рассмотрим несколько примеров расчета рН до точки эквивалентности (в растворе присутствует неоттитрованная кислота).
Пусть добавлено 5, 0 мл 0, 1 М NaOH. Концентрация [H+] – ионов равна
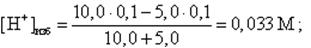
pH = -lg [H+]изб = -lg 0, 033 = 1, 5
Аналогично рассчитываются любые другие точки на кривой титрования до точки эквивалентности (данные приведены в таблице 2), в том числе и рН в начале скачка на кривой титрования. В этом случае недотитровано 0, 1 % кислоты, т. е. добавлено NaOH на 0, 1 % меньше, чем требуется для полной нейтрализации HCl. Так как концентрации кислоты и щелочи равны, то это означает, что щелочи добавлено 9, 99 мл (10, 0 мл составляет 100 %):
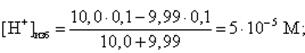
тогда pH = -lg(5 · 10-5)= 4, 3
При рН=7 раствор нейтрализован полностью, по закону эквивалентов соответствующий эквивалентный объем равен: Vэкв(NaOH)=10·0, 1/0, 1=10, 0 мл.
|
|
|
Конец скачка рассчитывается для избыточного содержания в растворе NaOH в количестве 0, 1 %, т. е. всего добавлено 10, 01 мл 0, 1 М NaOH. В этом случае
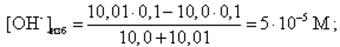
pH = 14 + lg[OH-]изб = 14 + lg(5· 10-5) = 9, 7
Аналогично рассчитываются все другие точки на кривой титрования за точкой эквивалентности. Например, добавлено 11, 0 мл 0, 1 М NaOH:
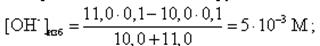
pH = 14 + lg[OH-]изб = 14 + lg(5· 10-3) = 11, 7
Таблица 2.
Расчет кривой титрования 10, 0 мл 0, 1 М HCl раствором 0, 1 М NaOH
| № | V(NaOH), мл | [H+], моль/л | [OH-], моль/л | pH |
| 1. | 0, 00 | 0, 100 | - | 1, 0 |
| 2. | 2, 50 | 0, 060 | - | 1, 2 |
| 3. | 5, 00 | 0, 033 | - | 1, 5 |
| 4. | 9, 00 | 5 · 10- 3 | - | 2, 3 |
| 5. | 9, 90 | 5 · 10- 4 | - | 3, 3 |
| 6. | 9, 99 | 5 · 10- 5 | - | 4, 3 |
| 7. | 10, 00 | 1 · 10- 7 | 1 · 10- 7 | 7, 0 |
| 8. | 10, 01 | - | 5 · 10- 5 | 9, 7 |
| 9. | 10, 10 | - | 5 · 10- 4 | 10, 7 |
| 10. | 11, 00 | - | 5 · 10- 3 | 11, 7 |
| 11. | 15, 00 | - | 0, 02 | 12, 3 |
Анализ кривой титрования
В начале титрования рН изменяется очень медленно. С уменьшением концентрации оставшейся кислоты изменение рН при титровании становится более резким. Величина скачка рН на кривой титрования в данном случае достаточно велика и составляет 5, 4 единицы:
Δ рН = рН конца скачка - рН начала скачка = 9, 7 - 4, 3 = 5, 4.
Кривая титрования симметрична относительно точки эквивалентности, которая лежит в нейтральной среде. Величина скачка титрования зависит от концентрации реагирующих веществ. Чем меньше концентрация реагентов, тем меньше скачок титрования. К уменьшению скачка титрования приводит повышение температуры, т. к. возрастает величина ионного произведения воды (при 80° С скачок составляет, например, 4. 6 единицы).
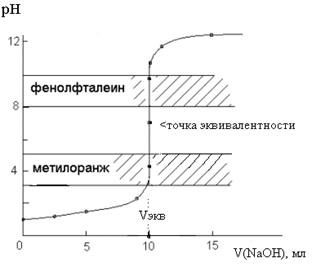
Рис. 1. Кривая титрования 10, 0 мл 0, 1 М HCl раствором 0, 1 М NaOH
Кривая титрования сильного основания сильной кислотой рассчитывается аналогично, представляя собой зеркальное изображение кривой титрования сильной кислоты сильным основанием. До точки эквивалентности рН раствора определяется концентрацией неоттитрованной щелочи и рассчитывается по формулам (11, 12). После точки эквивалентности рН раствора определяется концентрацией кислоты, которая будет находиться в избытке, и рассчитывается по формуле (9, 10). В точке эквивалентности раствор нейтрален (рН = 7. 0), по закону эквивалентов Vэкв(НСl)=10, 0·0, 1/0, 1=10, 0 мл. Величина скачка и его положение на кривой титрования остаются такими же, какими они были при титровании сильной кислоты сильным основанием.
|
|
|
Расчетные данные кривой титрования 10, 0 мл 0, 1 М NaOH раствором 0, 1 М HCl приведены в таблице 3.
Таким образом, в случае титрования сильной кислоты щелочью и наоборот можно из двух широко используемых индикаторов (фенолфталеина и метилоранжа) использовать оба, т. к. интервалы перехода окраски метилоранжа (3, 1 – 4, 4) и фенолфталеина (8, 3 – 10, 0) попадают в интервал скачка рН на кривой титрования (4, 3 – 9, 7)
Таблица 3.
Расчет кривой титрования 10, 0 мл 0, 1 М NaOH раствором 0, 1 М HCl
| № | V(HCl), мл | [OH-], моль/л | [H+], моль/л | pH |
| 1. | 0, 00 | 0, 100 | - | 13, 0 |
| 2. | 2, 50 | 0, 060 | - | 12, 8 |
| 3. | 5, 00 | 0, 033 | - | 12, 5 |
| 4. | 9, 00 | 5 · 10- 3 | - | 11, 7 |
| 5. | 9, 90 | 5 · 10- 4 | - | 10, 7 |
| 6. | 9, 99 | 5 · 10- 5 | - | 9, 7 |
| 7. | 10, 00 | 1 · 10- 7 | 1 · 10- 7 | 7, 0 |
| 8. | 10, 01 | - | 5 · 10- 5 | 4, 3 |
| 9. | 10, 10 | - | 5 · 10- 4 | 3, 3 |
| 10. | 11, 00 | - | 5 · 10- 3 | 2, 3 |
| 11. | 15, 00 | - | 0, 02 | 1, 7 |
|
|
|


