 |
Пример 4. Задачи для самостоятельного решения. Тестовые задания. Выберите один правильный ответ
|
|
|
|
Пример 4.
Эндотермическая реакция разложения пентахлорида фосфора протекает по уравнению РС15(г) ↔ РС13(г) + С12(г); ∆ Н = +92, 59 кДж. Как надо изменить: а) температуру; б) давление; в) концентрацию, чтобы сместить равновесие в сторону прямой реакции — разложения РС15?
Решение:
Смещением или сдвигом химического равновесия называют изменение равновесных концентраций реагирующих веществ в результате изменения одного из условий реакции. Направление, в котором сместилось равновесие, определяется по принципу Ле Шателье: а) так как реакция разложения РС15 эндотермическая ( 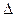 H > 0), то для смещения равновесия в сторону прямой реакции нужно повысить температуру: б) так как в данной системе разложение РС15 ведет к увеличению объема (из одной молекулы газа образуются две газообразные молекулы), то для смещения равновесия в сторону прямой реакции надо уменьшить давление; в) смещения равновесия в указанном направлении можно достигнуть как увеличением концентрации РС15, так и уменьшением концентрации РС13 или Сl2.
H > 0), то для смещения равновесия в сторону прямой реакции нужно повысить температуру: б) так как в данной системе разложение РС15 ведет к увеличению объема (из одной молекулы газа образуются две газообразные молекулы), то для смещения равновесия в сторону прямой реакции надо уменьшить давление; в) смещения равновесия в указанном направлении можно достигнуть как увеличением концентрации РС15, так и уменьшением концентрации РС13 или Сl2.
Задачи для самостоятельного решения
1. Определите, как изменится скорость реакции синтеза аммиака при а) увеличении концентрации исходных веществ в 3 раза; б) при уменьшении давления в реакционной смеси в 2 раза.
2. Как изменится скорость прямой реакции 2СО + О2 ↔ 2СО2 при увеличении концентрации СО в 3 раза?
3. Как изменится скорость прямой реакции 2NO + O2 ↔ 2NO2 при увеличении давления в 2 раза?
4. Определите, как изменится скорость реакции 2SO2 + O2 = 2SO3 при уменьшении концентрации SO2 в два раза и увеличении концентрации О2 в 4 раза.
5. Скорость реакции уменьшается в 6, 25 раза при понижении температуры на 200С. Найдите температурный коэффициент реакции.
|
|
|
6. Во сколько раз уменьшится скорость окисления глюкозы при гипотермии, если температура тела падает с 36, 6 до 27°С, а температурный коэффициент данной реакции равен 1, 3?
7. Константа скорости распада пенициллина при 360С равна 6·10-6 сек-1, а при 410С – 1, 2·10-5 сек-1. Вычислить температурный коэффициент реакции.
8. Химическая реакция при 100С заканчивается за 16 мин. При какой температуре она закончится за 1 мин при температурном коэффициенте реакции равном 2?
9. Температурный коэффициент скорости некоторой реакции равен 2, 8. Во сколько раз увеличится скорость реакции при уменьшении температуры от 15 до 35 0С?
10. Температурный коэффициент скорости некоторой реакции равен 2, 5. Как нужно повысить температуру, чтобы скорость реакции возросла в 25 раз?
11. Скорость реакции увеличилась в 5, 6 раза при повышении температуры реакционной смеси на 20К. Как изменится скорость реакции при понижении температуры от 57 до 17 0С?
12. Некоторая реакция характеризуется следующими параметрами уравнения Аррениуса: А = 1, 5·1011 л/(моль·с), Еа = 86, 2 кДж/моль, Т = 298К. Рассчитать константу скорости реакции.
13. Для реакции синтеза иодоводорода из простых веществ энергия активации равна 166 кДж/моль, а предэкспоненциальный множитель в уравнении Аррениуса 1, 6·1014 мл/(моль·час) при 350 К. Вычислите константу скорости реакции.
14. В системе 2NO + O2 ↔ 2NO2 равновесные концентрации веществ составляют [NO] = 0, 2 моль/л, [O2] = 0, 3 моль/л, [NO2] = 0, 4 моль/л. Рассчитать Кравн и оценить положение равновесия.
15. Рассчитать величину константы равновесия для обратимой реакции 2NO + O2 ↔ 2NO2, если при состоянии равновесия [NO] = 0, 056 моль/л, [O2] = 0, 02 моль/л, [NO2] = 0, 044 моль/л.
16. Обратима ли практически реакция гидролиза глицил-глицина при 310 К, если ∆ G0р-ции = -15, 08 кДж/моль?
17. При 300 К константа равновесия реакции:
|
|
|
L-глутаминовая кислота + пируват ↔ α -кетоглутаровая кислота + L-аланин равна 1, 11. В каком направлении будет идти реакция при следующих концентрациях: L-глутаминовая кислота и пируват по 0, 00003 моль/л, α -кетоглутаровая кислота и L-аланин по 0, 005 моль/л?
18. Для реакции H3PO4 + аденозин ↔ АМФ + Н2О; ∆ G0 = 14 кДж/моль. В каком направлении реакция идет самопроизвольно при стандартных условиях? Каково значение константы равновесия?
19. Сделать заключение о практической обратимости реакции АТФ+АМФ↔ 2АДФ при 310 К, если ∆ G0 = -2, 10 кДж/моль.
20. В печени протекает ферментативный обратимый процесс:
глюкозо-1-фосфат ↔ глюкозо-6-фосфат.
При 370С равновесная концентрация глюкозо-1-фосфата 0, 001 моль/л, а глюкозо-6-фосфата – 0, 019 моль/л. Рассчитать Кравн.
Тестовые задания
Выберите один правильный ответ
1. Что изучает химическая кинетика?
1) Изучает возможность и направление химических реакций.
2) Изучает скорость и механизм химических реакций, и зависимость их от различных факторов.
3) Тепловой эффект химической реакции.
4) Изменение энтропии и энтальпии химических реакций от времени.
2. Для какой из реакций записано кинетическое уравнение скорости реакции v = k× C2A× CB:
1) А2(г) + В(г) ® С(г) 2) 2А(г) + В(тв) ® С(г)
3) А2(тв) + В(г) ® С(г) 4) 2А(г) + В(г) ® С(г)
3. Как изменится скорость реакции при повышении температуры на 20°, если температурный коэффициент скорости реакции равен 3?
1) Увеличится в 3 раза. 2) Увеличится в 6 раз.
3) Увеличится в 9 раз. 4) Увеличится в 60 раз.
4. Что такое молекулярность химической реакции?
1) Обще число молекул в единице объема.
2) Число молекул продуктов реакции.
3) Общее число молекул исходных веществ и продуктов реакции.
4) Число молекул, участвующих в элементарном акте реакции.
5. Для какой реакции справедливо утверждение, что скорость реакции – это изменение концентрации вещества в единицу времени:
1) Для любой реакции. 2) Для гетерогенной реакции.
3) Для обратимой реакции. 4) Для гомогенной реакции.
6. В чем заключается сущность действия катализатора?
1) Катализатор повышает энергию активации реакции.
2) Катализатор с реагирующими веществами образует неустойчивые промежуточные соединения, при этом энергия активации понижается.
|
|
|
3) Катализатор уменьшает долю активных частиц в реакционной смеси.
4) Катализатор смещает химическое равновесие и увеличивает выход продукта обратимой реакции.
7. Укажите единицы измерения скорости гетерогенной реакции
1) моль/(м2× с). 2) моль/(л× с). 3) л/(с× моль). 4) л2/(с× моль2).
8. Каков физический смысл константы скорости реакции?
1) Константа скорости реакции есть скорость реакции при постоянных концентрациях реагирующих веществ.
2) Характеризует зависимость скорости реакции от температуры.
3) Константа скорости есть скорость реакции при концентрации реагирующих веществ, равных единице.
4) Характеризует состояние химического равновесия.
9. Константа химического равновесия для реакции 2NO + O2 « 2NO2 имеет вид:
1)  . 2)
. 2) 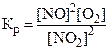 .
.
3) 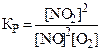 . 4)
. 4) 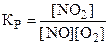 .
.
10. Система, в которой повышение давления и повышение температуры приведут к смещению равновесия в противоположных направлениях:
1) СО2(г) + С(т) « 2СО2(г) + Q. 2) I2(г) + 5CO2(г) « I2O5(т) + 5CO(г) – Q.
3) N2(г) + O2(г) « 2NO(г) – Q. 4) C2H2(г) + 2H2(г) « C2H6(г) + Q.
|
|
|


