 |
Примеры решения задач. Рассчитываем рН кислотного буферного раствора по формуле , тогда . Рассчитать буферную емкость по кислоте, если на титрование 10 мл сыворотки крови пошло 5 мл 0,1 моль/л соляной кислоты, если при титровании рН изменился от 7,3
|
|
|
|
Примеры решения задач
Пример 1.
Рассчитать рН буферного раствора, приготовленного смешением 10 мл 0, 1М раствора уксусной кислоты и 100 мл 0, 1М раствора ацетата натрия (рК(сн3 соон) =4, 76).
Решение:
Рассчитываем рН кислотного буферного раствора по формуле 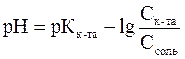 , тогда
, тогда 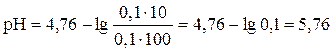
Ответ: 5, 76
Пример 2.
Рассчитать буферную емкость по кислоте, если на титрование 10 мл сыворотки крови пошло 5 мл 0, 1 моль/л соляной кислоты, если при титровании рН изменился от 7, 36 до 5, 0.
Решение:
Рассчитываем буферную емкость по формуле: 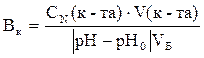
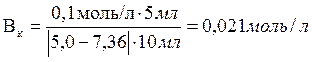
Ответ: 0, 021 моль/л
Пример 3.
Буферный раствор состоит из 100 мл 0, 1моль/л уксусной кислоты и 200 мл 0, 2моль/л ацетата натрия. Как изменится рН этого раствора, если к ней добавить 30 мл 0, 2моль/л раствора гидроксида натрия.
Решение:
Рассчитываем рН буферного раствора по формуле: 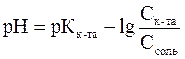
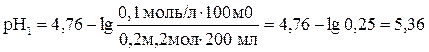
При добавлении к буферному раствору NaOH увеличивается количество соли и уменьшается количество кислоты в буферном растворе:
0, 006 0, 006 0, 006
СH3COOH + NaOH = CH3COONa + H2O
Рассчитываем n(NaOH) = 0, 03 л · 0, 2 моль/л = 0, 006 моль, следовательно в буферном растворе количество кислоты уменьшается на 0, 006 моль, а количество соли увеличится на 0, 006 моль. 
Рассчитываем рН раствора по формуле:
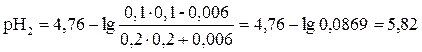
Отсюда: рН2 – рН1 = 5, 82 – 5, 3 = 0, 52
Ответ: изменение рН буферного раствора = 0, 52.
Задачи для самостоятельного решения
|
|
|
1. Рассчитать рН буферного раствора, приготовленного смешением 100 мл 0, 1М раствора дигидрофосфата натрия и 10 мл 0, 1М раствора гидрофосфата натрия (рК(Н2РО4 -) = 7, 21).
2. Рассчитать молярную концентрацию уксусной кислоты, если на приготовление ацетатного буфера с рН= 5, 76 к 100 мл 0, 1М раствора ацетата натрия прилили 10 мл уксусной кислоты (рК(сн3 соон) =4, 76).
3. Рассчитать Рн желудочного сока, если концентрация НС1 0, 365%, плотность 1г/мл.
4. На титрование 2 мл крови для изменения рН от начального значения (7, 36) до конечного значения (7, 0) потребовалось добавить 1, 6 мл 0, 01 М раствора HCl. Рассчитайте буферную емкость по кислоте.
5. Сколько моль ацетата натрия необходимо добавить к 300 мл уксусной кислоты, чтобы понизить концентрацию ионов водорода в 300 раз (Кдис (сн3 соон) = 1, 85. 10 -5 ).
6. При биохимических исследованиях используют фосфатный буфер с рН= 7, 4. В каком соотношении надо смешать растворы гидрофосфата натрия и дигидрофосфата натрия с концентрацией по 0, 1 моль/л каждый, чтобы получить такой буферный раствор (рК(Н2РО4 -) = 7, 4).
7. Какие нарушения КОС наблюдаются при следующих показателях: рН крови = 7, 20, Рсо2 = 38 мм рт. ст., БО = 30 ммоль/л, СБО = -4 ммоль/л. Как устранить данное нарушение КОС?
8. Рассчитать Рн ацетатного буферного раствора, состоящего из 60 мл 0, 2М раствора уксусной кислоты и 120 мл 0, 01М раствора ацетата натрия при рК(сн3соон) = 4, 76.
9. Рассчитать рН 0, 01М раствора уксусной кислоты, если степень диссоциации кислоты равна 0, 1.
10. Рассчитать объем 5% раствора гидрокарбоната натрия, необходимого для коррекции метаболического ацидоза, если сдвиг буферных оснований (ВЕ) составляет - 10 ммоль/л при массе больного 68 кг.
Тестовые задания
Выберите один правильный ответ
1. Заболевание, не вызывающее метаболический ацидоз:
1) сахарный диабет
2) почечная недостаточность
3) неукротимая рвота
|
|
|
4) сердечно-сосудистая недостаточность
2. Показатель, не относящийся к показателям КОС:
1) содержание глюкозы 2) ВЕ 3) рН 4) Рсо2
3. При компенсированном метаболическом ацидозе меняются показатели КОС:
1) рН ¯, Вк , ВЕ
2) рН , Вк , ВЕ ¯
3) рН ¯, Вк ¯, ВЕ ¯
4) рН ¯, Вк ¯, ВЕ ¯
4. Рн крови больного равен 7, 5; Рсо2 = 46 мм рт. ст.; ВЕ = +5 ммоль/л. Состояние КОС:
1) метаболический декомпенсированный алкалоз
2) метаболический декомпенсированный ацидоз
3) респираторный алкалоз
4) респираторный ацидоз
5. Активная кислотность желудочного сока 0, 01 н. Она соответствует значению рН:
1) 1 2) 2 3) 2, 5 4) 3
6. Кислым буфером является система:
1) СН3СООН + СН3СООNa 2) HCl + NaCl
3) H2SO4 + K2SO4 4) NH4OH + NH4Cl
7. На титрование 2, 5 мл крови пошло 3, 25 мл 0, 1М раствора гидроксида натрия, рН0=5, рН1=6, 3. Буферная емкость крови по щелочи равна:
1) 0, 05 моль/л 3) 0, 25 моль/л
2) 0, 5 моль/л 4) 0, 1 моль/л
8. рН буферного раствора, содержащего 0, 01 моль/л NH4OH и 0, 1 моль/л NH4Cl, рК (NH4OH) = 4, 8 равен:
1) 5, 8 3) 8, 2
2) 4, 8 4) 6, 8
9. Буферной системой крови является система:
1) H2CO3 + Na2CO3 3) СН3СООН + СН3СООNa
2) H2CO3 + NaHCO3 4) H3PO4 + Na3PO4
10. Алкалоз – это:
1) снижение Рн крови
2) повышение концентрации Н+
3) увеличение выработки основных продуктов в организме
4) увеличение выработки кислых продуктов в организме
11. Причиной возникновения респитаторного алкалоза является:
1) сахарный диабет 3) щелочная пища
2) пневмония 4) разрежение воздуха
12. Максимальную буферную емкость системы имеют при:
1) рН = РКа 2) рН > РКа
3) рН < Рка 4) эти параметры не взаимосвязаны
13. При гипервентиляции легких:
1) щелочной резерв крови уменьшается, Рн мочи увеличивается
2) щелочной резерв крови уменьшается, Рн мочи уменьшается
3) щелочной резерв крови увеличивается, Рн мочи увеличивается
4) щелочной резерв крови увеличивается, Рн мочи уменьшается
|
|
|
14. Соль слабой кислоты, входящей в состав кислотных буферных систем, является:
1) акцептором электронов 3) акцептором протонов
2) донором протонов 4) донором электронов
15. Для расчета Рн буферных систем используют уравнение:
1) Вант-Гоффа 3) Менделеева-Клайперона
2) Гендерсона-Хассельбаха 4) Михаэлис-Ментен
16. Физиологическое значение Рн поддерживается при соотношении компонентов фосфатной буферной системы, равном:
1) Н2РО4-/ HРO4-2= 4: 1 3) HРO4-2/Н2РО4- = 4: 1
2) HРO4-2/Н2РО4- = 18: 1 4) HРO4-2/Н2РО4- = 1: 18
17. Максимальный относительный вклад в поддержание протолитического гомеостаза в плазме крови вносит буферная система:
1) гидрокарбонатная 3) белковая
2) гидрофосфатная 4) гемоглобиновая
18. Какие свойства проявляет NaH2PO4 в гидрофосфатной буферной системе:
1) восстановительные 3) основные
2) окислительные 4) кислотные
19. Изоэлектрические точки большинства белков плазмы крови лежат в слабокислой среде, (рН = 4, 9-6, 3), поэтому в крови в основном работает:
1) катионный белковый буфер
2) анионный белковый буфер
3) форма компонентов буфера не зависит от Рн
4) белки находятся в состоянии цвитер-иона
20. Буферная емкость при разбавлении растворов:
1) уменьшается, вследствие уменьшения концентрации всех компонентов системы
2) увеличивается, т. к. возрастает степень диссоциации электролитов
3) не изменяется, т. к. соотношение концентрации компонентов остается постоянным
4) постоянно, т. к. количество компонентов системы остается неизменным
|
|
|


