 |
Тестовые задания. Выберите один верный ответ. Поверхностные явления. Адсорбция.
|
|
|
|
Тестовые задания
Выберите один верный ответ
1. Проводимость в проводниках II рода обеспечивается:
1) Электронами. 3) «Дырками».
2) Ионами. 4) Все ответы верны.
2. Величину электродного потенциала измеряют:
1) При помощи амперметра.
2) При помощи гальванометра.
3) При помощи калоримерта.
4) Путем измерения ЭДС гальванического элемента, составленного из исследуемого электрода и стандартного электрода, потенциал которого известен.
3. Дать наиболее полное определение понятия «гальванический элемент»:
1) Прибор, предназначенный для получения электрического тока.
2) Прибор, превращающий электрическую энергию в химическую.
3) Устройство, в котором химическая энергия окислительной и восстановительной электродных полуреакций превращается в электрическую благодаря переносу электронов по внешней цепи, а ионов – по внутренней цепи.
4) Это аккумулятор электрической энергии, возникающей за счет окислительно-восстановительных реакций.
4. Гальванический элемент работает самопроизвольно, если:
1) ЭДС> 0. 2) ЭДС< 0. 3) ЭДС = 0. 4) В любом случае.
5. Электродом I рода может быть:
1) Хлорсеребряный.
2) Ртутнокаломельный.
3) Цинковый.
4) Стеклянный.
6. Значение потенциала стандартного водородного электрода равно:
1) 0В. 2) +1 В. 3) -1 В. 4) 100 мВ.
7. К ионоселективным электродам относится:
1) Цинковый. 2) Водородный. 3) Стеклянный. 4) Хингидронный.
8. ЭДС – это:
1) Потенциал электрода, измеренный при любых условиях.
2) Потенциал электрода, измеренный при стандартных условиях.
3) Разность потенциалов.
|
|
|
4) Произведение потенциалов.
9. Реакция лежащая в основе работы водородного электрода:
1) Н+ + ОН- « Н2О.
2) Н+ + Н2О « Н3О+.
3) 2Н+ + 2ē « H2.
4) Н + le ® H-.
10. Для измерения рН можно использовать:
1. Хлорсеребряный электрод. 3. Водородный электрод.
2. Стандартный водородный электрод. 4. Цинковый электрод.
ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ. АДСОРБЦИЯ.
В каждой живой системе имеется большое количество поверхностей раздела: поверхность кожи, стенок кровеносных сосудов, клеточные мембраны, поэтому поверхностные явления представляют для биологии и медицины большой интерес. Свойства поверхностных слоёв вещества отличаются от свойств вещества в объеме, особенности поведения веществ, которые наблюдаются на поверхностях раздела фаз, называются поверхностными явлениями.
К поверхностным явлениям относятся поверхностное натяжение и сорбция.
Поверхностное натяжение (σ ) – это свободная поверхностная энергия, приходящаяся на единицу межфазной поверхности. Для изобарно-изотермического процесса:
σ = (dGп / dSп )Р, Т, n, [σ ] = Дж/м2 или Н/м.
Поверхностное натяжение растворов, как правило, отличается от σ чистого растворителя. По влиянию на поверхностное натяжение все вещества подразделяются на 3 группы: 1) вещества, понижающие поверхностное натяжение, называются поверхностно-активными (ПАВ); 2) вещества, повышающие поверхностное натяжение, называются поверхностно-инактивными (ПИВ); 3) вещества, растворение которых практически не влияет на поверхностное натяжение, называются поверхностно-неактивными (ПНВ).
Одним из методов, позволяющих определить относительную величину поверхностного натяжения, является сталагмометрический метод Траубе или метод счета капель. Расчет поверхностного натяжения проводят по формуле:
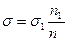 , где
, где
σ — поверхностное натяжение исследуемой жидкости,
|
|
|
σ 1 —поверхностное натяжение воды,
n1 — число капель воды,
n — число капель исследуемой жидкости.
Явление поглощения твердым или жидким телом веществ из внешней среды называется сорбцией. Сорбция, происходящая только на поверхности тела, называется адсорбцией (Г). Если же поглощение происходит всей толщей поглотителя, то такое явление называют абсорбцией.
Величина адсорбции зависит от природы адсорбента и адсорбтива, от температуры, от давления газа или концентрации растворенного вещества.
Адсорбция на границе раздела жидкость-газ описывается уравнением Дж. Гиббса:
Г = - (СМ / RT) ∙ (dσ /dc),
где Г – избыточная адсорбция вещества, СМ – его молярная концентрация в растворе, Т – температура, при которой происходит адсорбция, (dσ / dc) – изменение поверхностного натяжения раствора при изменении концентрации на dc.
Адсорбция положительна, когда (dσ / dc)< 0 или отрицательна, когда (dσ / dc)> 0. Величина -(dσ / dc) = g называется поверхностной активностью. Таким образом:
для ПАВ поверхностная активность и адсорбция положительны: (dσ / dc) < 0; g > 0; Г > 0;
для ПИВ- (dσ / dc) > 0; g < 0; Г < 0;
для ПНВ- (dσ / dc) = 0; g = 0; Г = 0.
Правило Дюкло – Траубе: Поверхностная активность предельных жирных кислот (и других гомологических рядов ПАВ) в водных растворах возрастает в 3 – 3, 5 раза при удлинении углеводородной цепи на одно звено (группу –СН2).
Адсорбция на границе раздела твердое тело – жидкость, описывается уравнениями Фрейндлиха или Лэнгмюра.
Эмпирическое уравнение Фрейндлиха имеет вид:
(х /m) = aC1/n,
где х – количество поглощенного вещества в молях или см3; m – масса поглотителя в г; С – равновесная концентрация; а и n – константы, характерные для данного процесса адсорбции (n > 1).
Уравнение Фрейндлиха неприменимо в области малых и больших концентраций адсорбируемого вещества.
Более универсальным является уравнение адсорбции Ленгмюра, которое часто используют в медико-биологических исследованиях:
Г = Г∞ ∙ (с / (К+c)),
где Г∞ - количество адсорбируемого вещества в молях при полном насыщении единицы поверхности, моль/г; Г – количество адсорбируемого вещества в молях единицей поверхности поглотителя, моль/г; с – равновесная концентрация адсорбата, моль/л; К – константа адсорбционного равновесия.
|
|
|
Адсорбция на границе раздела твердое тело – газ описывается уравнениями Фрейндлиха или Лэнгмюра, но вместо равновесной концентрации С подставляют давление Р:
(х / m) = aР1/n,
Г = Г∞ ∙ (Р: (К+Р)).
|
|
|


