 |
Гидрофобные Золи
|
|
|
|
В окружающей нас природе, как и в живом организме, редко встречаются индивидуальные химические вещества. Чаще многообразие веществ, составляющих живую и неживую природу, представлено в виде растворов или в виде дисперсных систем.
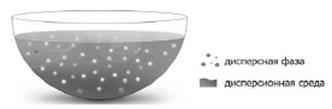 Дисперсной системой называется гетерогенная система, в которой одна из фаз представлена мелкими частицами, равномерно распределенными в объеме другой однородной фазы.
Дисперсной системой называется гетерогенная система, в которой одна из фаз представлена мелкими частицами, равномерно распределенными в объеме другой однородной фазы.
 Всякая дисперсная система состоит из дисперсной фазы и
Всякая дисперсная система состоит из дисперсной фазы и
дисперсионной среды.
Дисперсную фазу составляют мелкораздробленные частицы, равномерно распределенные в дисперсной системе.
Дисперсионную среду составляет однородная непрерывная фаза, в которой распределены частицы дисперсной фазы.
В биологических системах, например в крови человека, содержатся малорастворимые соли кальция, магния, а также холестерин и другие малорастворимые вещества, существующие в виде лиофобных коллоидных растворов, которые принято называть золями. Системы с газовой дисперсионной средой, независимо от природы газа, называют аэрозолями. Системы с жидкой дисперсионной средой – лиозолями.
Золи (коллоидные растворы) – высокодисперсные системы с жидкой дисперсионной средой. Размер частиц дисперсной фазы обычно лежит в пределах 10-7 – 10-5 см.
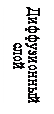
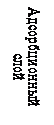

 В зависимости от интенсивности взаимодействия дисперсной фазы с дисперсионной средой различают лиофильные и лиофобные системы. Если дисперсионной средой является вода, то соответствующие системы называются гидрофильными и гидрофобными, соответственно. В гидрофильных системах дисперсная фаза хорошо взаимодействует с водой, а в гидрофобных плохо. Как следствие, в лиофильных системах поверхностное натяжение на границе раздела фаз невелико; в них мала и поверхностная энергия, что делает их термодинамически устойчивыми. В лиофобных системах поверхностное натяжение на межфазной границе большое; они обладают большей поверхностной энергией и являются термодинамически неустойчивыми.
В зависимости от интенсивности взаимодействия дисперсной фазы с дисперсионной средой различают лиофильные и лиофобные системы. Если дисперсионной средой является вода, то соответствующие системы называются гидрофильными и гидрофобными, соответственно. В гидрофильных системах дисперсная фаза хорошо взаимодействует с водой, а в гидрофобных плохо. Как следствие, в лиофильных системах поверхностное натяжение на границе раздела фаз невелико; в них мала и поверхностная энергия, что делает их термодинамически устойчивыми. В лиофобных системах поверхностное натяжение на межфазной границе большое; они обладают большей поверхностной энергией и являются термодинамически неустойчивыми.
|
|
|
 В природе лиофобные коллоидные растворы могут существовать длительное время без существенных изменений. Это обеспечивается присутствием стабилизатора, молекулы или ионы которого, адсорбируясь на поверхности частиц, увеличивают их сродство к дисперсионной среде и препятствуют слипанию частиц между собой. Из всего сказанного выше следует, что лиофобные коллоидные растворы могут образовываться и существовать при соблюдении следующих основных условий:
В природе лиофобные коллоидные растворы могут существовать длительное время без существенных изменений. Это обеспечивается присутствием стабилизатора, молекулы или ионы которого, адсорбируясь на поверхности частиц, увеличивают их сродство к дисперсионной среде и препятствуют слипанию частиц между собой. Из всего сказанного выше следует, что лиофобные коллоидные растворы могут образовываться и существовать при соблюдении следующих основных условий:
- малая растворимость дисперсной фазы, т. е. плохое сродство ее к дисперсионной среде;
- определенные размеры частиц дисперсной фазы (10-9 – 10-6 м);
- присутствие в системе стабилизатора.
Лиофобные золи обладают рядом специфических свойств: электрических, оптических, молекулярно-кинетических и др. Многие важные свойства золей и, в частности, их устойчивость, обусловлены возникновением на поверхности частиц двойного электрического слоя (ДЭС), который образуется благодаря адсорбции ионов стабилизатора на частицах дисперсной фазы. Образовавшиеся при этом микроструктуры представляют собой мицеллы лиофобных коллоидных систем.
Мицеллой лиофобной системы (от лат. micellа - крошка, крупинка) называется гетерогенная микросистема, которая состоит из микрокристалла дисперсной фазы, окруженного сольватированными ионами стабилизатора.
Мицелла (рис. 2. ) состоит из электронейтрального агрегата и ионогенной части. Масса коллоидной частицы сосредоточена главным образом в агрегате, который состоит из сотен атомов и молекул нерастворимого в воде вещества и имеющего кристаллическое или аморфное строение. Ионогенная часть мицеллы делится на адсорбционный и диффузионный слои, которые формируют двойной электрический слой. Агрегат в результате избирательной адсорбции ионов или ионизации поверхностных молекул приобретает заряд. Ионы, определяющие заряд агрегата, называют потенциалопределяющими. Согласно правилу Фаянса-Пескова это те ионы, которые входят в состав кристаллической решетки ядра. Агрегат и потенциалопределяющие ионы образуют ядро. С заряженной поверхностью ядра устойчиво связано некоторое число ионов противоположного знака- противоионов. Потенциалопределяющие и противоионы образуют адсорбционный слой. Агрегат вместе с адсорбционным слоем называют гранулой (частицей). Заряд гранулы равен сумме зарядов прочно связанных противо- и потенциалопределяющих ионов. Электролит, один из ионов которого адсорбирован на ядре, называется стабилизатором (обычно это тот электролит, который взят в избытке), он сообщает устойчивость коллоидным частицам.
|
|
|
Рассмотрим строение мицелл золя AgI. Его можно получить взаимодействием разбавленных растворов AgNO3 и KI по реакции:
m AgNO3 + (m+n)KI ® mAgI . nI- + nK+ + mKNO3
При этом устойчивый золь может быть получен при соблюдении двух условий: (1) растворы реагентов должны быть разбавленными и (2) одно из реагирующих веществ берется в избытке. В зависимости от того, какое из веществ взято в большом количестве, заряд частиц золя будет разный.
В первом случае (при избытке AgNO3) формулу мицеллы можно записать следующим образом:
{[m(AgI)nAg+ 3n-x)NO-]3х+ 3xNO-}
Во втором случае (при избытке KI) формула мицеллы приобретет вид:
{[m(AgI)nI- (n-x)K+]x- xK+}
В этих формулах m означает количество молекул AgI в ядре, n – число потенциалопределяющих ионов, адсорбированных на поверхности ядра, (n-x) – число противоионов в адсорбционном слое, х – их число в диффузионном слое.
Из приведенных формул видно, что первая мицелла имеет положительно заряженную гранулу вследствие преимущественной адсорбции на ядре катионов серебра (положительный золь), а гранула второй мицеллы заряжена отрицательно за счет отрицательных ионов иода (отрицательный золь). Если же растворы нитрата серебра и иодида калия взяты в эквивалентных количествах, устойчивой коллоидной системы не образуется. Образовавшиеся коллоидные частицы не несут электрических зарядов, т. е. электрокинетический потенциал равен нулю. Состояние коллоидной системы, при котором электрокинетический потенциал равен нулю, называется изоэлектрическим. Изоэлектрическое состояние наступает у коллоидов с заряженными частицами, если к ним прибавить электролит.
|
|
|
В мицелле с ионным стабилизатором, как во всякой гетерогенной системе, в которой на границе раздела фаз имеется двойной электрический слой, различают два потенциала: межфазный j и электрокинетический, или z – потенциал (дзета-потенциал).
Межфазным потенциалом называется потенциал ДЭС на границе раздела между твердой и жидкой фазами в мицелле (Рис. 2., граница АА).
Электрокинетическим потенциалом называется потенциал на границе скольжения между адсорбционной и диффузионной частями ДЭС мицеллы (Рис. 2, граница ВВ). Причем из гидродинамики известно, что плоскость скольжения движущегося твердого тела в жидкости проходит не по границе адсорбционный слой Гельмгольца – диффузионный слой, а на некотором расстоянии от нее. Поверхность, по которой происходит перемещение, называется поверхностью скольжения. Скачок потенциала на границе неподвижный слой жидкости и будет электрокинетическим, или дзета-потенциалом.
Электрокинетический потенциал – часть электротермодинамического. Его значение определяется толщиной диффузного слоя и обычно составляет несколько десятков милливольт (50-70 мВ). Если диффузный слой предельно сжат, то z =0. При сжатии диффузного слоя, например, вследствие увеличения концентрации электролитов в дисперсионной среде, часть противоионов переходит за поверхность скольжения в адсорбционный слой. Электротермодинамический потенциал j при этом не изменятся, а z- потенциал уменьшается по абсолютному значению. Диффузный слой как бы связывает коллоидные частицы со всей дисперсионной средой и тем самым препятствует их слипанию. Следовательно, с уменьшением электрокинетического потенциала должна уменьшаться и устойчивость коллоидной системы. При наличии многозарядных противоионов с ростом концентрации электролита дзета-потенциал не только уменьшается, но может изменить знак и происходит перезарядка коллоидных частиц. При этом влияние ионов на z- потенциал возрастает в гораздо большей степени, чем возрастает их заряд. Так, для ионов K+, Ba2+, Al3+ их заряды относятся как 1: 2: 3, а концентрации, производящие одинаковое действие, относятся как 800: 25: 1. Электрокинетический потенциал зависит от температуры. С одной стороны, с повышением температуры толщина диффузионного слоя возрастает и это должно привести к увеличению электрокинетического потенциала. С другой стороны, с ростом температуры адсорбция уменьшается вследствие десорбции потенциалопределяющих ионов. Этот процесс приводит к уменьшению электротермодинамического потенциала j и, следовательно его составляющей части – электрокинетического потенциала z. Скорость электрофореза прямо связана с величиной дзета-потенциала, и поэтому его определяют опытным путем по скорости движения коллоидных частиц в электрическом поле.
|
|
|
При броуновском движении частицы коллоидных систем могут сталкиваться друг с другом и образовывать более крупные агрегаты. Таким образом в коллоидных системах всегда имеются реальные условия для нарушения устойчивости. Что в свою очередь проявляется в появлении патологических процессов таких как камнеобразование. Для биологических жидкостей это например, изменение количества форменных элементов крови (эритроцитов, лейкоцитов и др. ), скорости оседания эритроцитов (СОЭ), свертываемости крови и др.
Устойчивость дисперсных систем характеризует способность дисперсной фазы сохранять состояние равномерного распределения частиц дисперсной фазы во всем объеме дисперсионной среды.
По предложению Пескова устойчивость дисперсных систем подразделяют на седиментационную и агрегативную.
Седиментационная устойчивость характеризует способность частиц дисперсной фазы находиться во взвешенном состоянии и не оседать под действием сил тяжести.
Агрегативная устойчивость характеризует способность частиц дисперсной фазы противодействовать их слипанию между собой и тем самым сохранять неизменными свои размеры.
Потеря коллоидными системами агрегативной устойчивости приводит к коагуляции дисперсной фазы.
Коагуляция - процесс слипания частиц, образования более крупных агрегатов, в результате чего система теряет седиментационную устойчивость, происходит разделение фаз и дисперсная система разрушается.
|
|
|
Наиболее широко признанной в настоящее время теорией устойчивости дисперсных систем является теория ДЛФО. Её разработали советские ученые Дерягин и Ландау в 1937-1941 гг., а в 1945-1946 гг. – независимо от них голландские ученые Фервей и Овербек. Сущность теории ДЛФО заключается в следующем: агрегативная устойчивость в ультрамикрогетерогенных системах обеспечивается преобладанием сил электростатического отталкивания над силами межмолекулярного притяжения, действующими между частицами дисперсной фазы.
Практически коагуляцию можно вызвать различными воздействиями: добавлением небольших количеств электролита, концентрированием коллоидного раствора, изменением температуры, действием ультразвука, электромагнитного поля и др. Коагуляцию коллоидного раствора может вызвать любой электролит. Однако для каждого электролита необходима своя минимальная концентрация, называемая порогом коагуляции (Спк).
Порогом коагуляции называется минимальное количество электролита, которое надо добавить к коллоидному раствору, чтобы вызвать явную коагуляцию (заметную на глаз)- помутнение раствора или изменение окраски.
Порог коагуляции можно рассчитать по формуле:
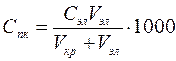 , (ммоль/л) ( 1 )
, (ммоль/л) ( 1 )
где Сэл – исходная концентрация раствора электролита, моль/л; Vэл – объем раствора электролита, добавленного к коллоидному раствору, мл; Vкр – объем коллоидного раствора, мл.
Величина, обратная порогу коагуляции, называется коагулирующим действием (γ ):
γ = 1/Cпк ( 2 )
Коагулирующее действие электролитов на коллоидные растворы с ионным стабилизатором подчиняется правилу Шульце-Гарди:
Коагуляцию коллоидных растворов вызывают любые ионы, которые имеют знак заряда, противоположный заряду гранул. Коагулирующее действие ионов тем сильнее, чем выше заряд иона-коагулянта.
Коагулирующее действие иона-коагулянта прямо пропорционально его заряду в шестой степени: γ = f(z6).
Явление коагуляции лежит в основе многих патологических процессов в организме. Например, коагуляция коллоидных растворов фосфата кальция и холестерина в крови приводит к образованию осадков и отложению их на внутренней поверхности кровеносных сосудов (склеротические изменения сосудов).
Примеры решения задач:
|
|
|


