 |
Задачи для самостоятельного решения
|
|
|
|
Задачи для самостоятельного решения
1. К какому электроду будут передвигаться частицы белка (рI =4, 0) при электрофорезе в ацетатном буфере, приготовленном из 10 мл раствора ацетата натрия с концентрацией 0, 1 моль/л и 50 мл 0, 2 моль/л уксусной кислоты (рКкислоты =4, 76)?
2. Будет ли происходить набухании е желатины (рI=4, 7) в ацетатном буфере, приготовленном из 10 мл ацетата натрия и 100 мл уксусной кислоты (одинаковых концентраций) (рК=4, 76).
3. Изоэлектрическая точка пепсина желудочного сока равна 2, 0. Как будет заряжен этот белок при нормальной кислотности желудочного сока взрослого человека. Ответ поясните.
4. В двух пробирках раствор белка, имеются два электролита: сульфат натрия и хлорид свинца. Какой из электролитов необходимо добавить для осаждения белка без нарушения структуры? Каков механизм осаждения белков при использовании этих электролитов?
5. Назовите и опишите реакции осаждения белка, применяемые в клинике. Почему эти реакции наиболее надёжны?
6. К какому электроду будут передвигаться при электрофорезе белки b-лактоглобулины в буферном растворе с рН=8, 6, если при рН=5, 2 белок остается на старте?
7. В какой среде необходимо прокипятить сыворотку крови для полного удаления белков, если ИЭТ белков крови меняется от 4, 5 до 6, 0?
8. Какие реактивы необходимо использовать:
а) для получения безбелкового фильтрата крови;
б) для выделения белков для дальнейшего изучения структуры белков.
9. Имеются следующие реактивы: сульфосалициловая кислота, конц. H2SO4 , крист. (NH4)2SO4, трихлоруксусная кислота, насыщ. раствор хлорида натрия. Объясните выбор растворов и механизм осаждения в каждом случае.
10. ИЭТ гемоглобина рН = 6, 68. Белок поместили в буферный раствор с концентрацией ионов водорода 10-6 моль/л. Определите направление движения молекул гемоглобина при электрофорезе. Известно, что рН в эритроцитах равен 7, 25. Какой заряд имеют белковые молекулы гемоглобина при этом значении рН?
|
|
|
11. К какому электроду будут передвигаться частицы белка (ИЭТ = 4, 0) при электрофорезе в ацетатном буфере, приготовленном из 100 мл раствора ацетата натрия с концентрацией 0, 1 моль/л и 50 мл раствора уксусной кислоты с концентрацией 0, 2 моль/л? (рКкислоты=4, 76)
Тестовые задания
Выберите один правильный ответ
1. Денатурация белка сопровождается:
1) нарушением первичной структуры
2) нарушением структур, кроме первичной
3) высаливанием
4) образованием четвертичной структуры
2. Изоэлектрическая точка белка гистона, содержащего большое количество аминокислоты лизина находится в растворе:
1) кислом 2) нейтральном 3) щелочном 4) нельзя определить
3. Высаливание белка протекает под воздействием:
1) температуры
2) конц. азотной кислоты
3) насыщенного раствора хлорида натрия
4) концентрированного раствора ацетета свинца
4. Заряд белка с изоэлектрической точкой 4, 6 в крови:
1) положительный 2) отрицательный 3) не имеет заряда
5. Первичная структура белка поддерживается связями:
1) водородными
2) сложноэфирными
3) электростатическими
4) пептидными
5) дисульфидными
6. При кислотном гидролизе простых белков образуется:
1) смесь аминокислот и двухатомных спиртов
2) смесь аминокислот
3) смесь различных эфиров
4) смесь альдегидов и аминокислот
5) смесь моносахаридов
7. В образовании третичной структуры белков участвуют:
1) гидрофобные взаимодействия
2) водородные связи
3) дисульфидные мостики
4) электростатические взаимодействия
5) все ответы правильные
8. Четвертичная структура характерна для белков, имеющих в своем составе:
|
|
|
1) несколько полипептидных цепей
2) два азотистых основания
3) несколько моносахаридных звеньев
4) липидные фрагменты
5) многоатомные спирты
9. Разновидности вторичной структуры белка:
1) полициклическая
2) α –спираль и β - структура
3) гетероциклическая
4) простая и разветвленная цепь
5) нет правильного ответа
10. При денатурации белка не нарушается:
1) вторичная структура
2) четвертичная структура
3) третичная структура
4) первичная структура
5) все перечисленные структуры.
ОСНОВНЫЕ ПРИНЦИПЫ КЛАССИФИКАЦИИ И НОМЕНКЛАТУРЫ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ. ПРОСТРАНСТВЕННОЕ СТРОЕНИЕ ОРГАНИЧЕСКИХ МОЛЕКУЛ. ЭЛЕКТРОННОЕ СТРОЕНИЕ ХИМИЧЕСКИХ СВЯЗЕЙ АТОМА УГЛЕРОДА И ВЗАИМНОЕ ВЛИЯНИЕ АТОМОВ В ОРГАНИЧЕСКИХ МОЛЕКУЛАХ.
СОПРЯЖЕННЫЕ СИСТЕМЫ
Основные принципы номенклатуры органических соединений
При построении названия по МН используются следующие операции:
1) выбор главной цепи,
2) нумерация цепи,
3) построения названия.
I. Выбор главной цепи: она не всегда самая длинная, но обязательно должна содержать старшую функциональную группу.
II. Нумерация цепи: главная функциональная группа должна иметь наименьший номер.
III. Название соединения.
При этом название состоит из следующих блоков:
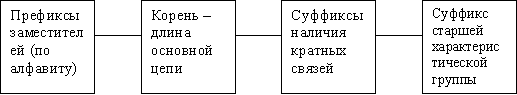
Ключевым моментом в составлении названия является выбор основной цепи.
Алгоритм выбора основной цепи:
1) В основную цепь должна входить старшая характеристическая группа
2) В нее должны максимально быть включены кратные связи
3) Основная цепь должна быть максимально длинной
4) Выбирают самую разветвленную цепь.
5) Цепь нумеруется так, чтобы сумма номеров заместителей была наименьшей. В качестве примера назовем следующее соединение:
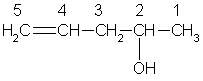 пентен-4–ол-2
пентен-4–ол-2
Сопряженные системы - это системы с чередующимися двойными и одинарными связями. Они могут быть открытыми и закрытыми. Открытая система имеется в диеновых углеводородах (УВ).
Сопряжение – процесс энергетически выгодный, энергия (Е) при этом выделяется.
Ароматичность. Это понятие, включающее различные свойства ароматических соединений.
|
|
|
Условия ароматичности:
1) плоский замкнутый цикл;
2) все атомы С находятся в sp2-гибридизации;
3) образуется единая сопряженная система всех атомов цикла;
4) выполняется правило Хюккеля: в сопряжении участвуют (4n + 2)р-электронов, где n = 1, 2, 3
5) Простейший представитель ароматических углеводородов – бензол. Он соответствует всем четырем условиям ароматичности.
Правило Хюккеля: 4n + 2 = 6, n = 1.
Взаимное влияние атомов. Причиной смещения валентных электронов в
молекуле является различие в электроотрицательности элементов,
образующих молекулу.
Взаимное влияние атомов в молекуле передается двумя путями:
индуктивным и мезомерным эффектами.
Индуктивный эффект (I-эффект) – это передача электронного влияния заместителей по цепи σ -связей.
Электрооттягивающие заместители снижают элекронную плотность в системе σ -связей, и их называют электроноакцепторными, вызывая (-I) эффект. К ним относят: Hal, -OH, -OR, -NH2, -COH, -COOH, -NO2, -SO3H.
Элекроноподающие заместители повышают электроннную плотность в цепи σ -связей по сравнению с атомом водорода, т. е. проявляют +I эффект и являются элекронодонорными. К ним относятся атомы с низкой электроотрицательностью (алкил-радикалы, металлы), а также отрицательно заряженные атомы или группы, обладающие избытком электронной плотности, которую они стремятся перераспределить на соседние связи.
Мезомерный эффект, или эффект сопряжения (М-эффект), - это передача электронного влияния эаместителей по сопряжённой системе. Заместители влияют на одни и те же положения в кольце, но с различным результатом. Часть из них, которые имеют +М- и +I-эффекты, увеличивают электронную плотность в кольце в целом, и по о- и п-положениям относительно себя, в частности. Заместители подразделяют на две группы в зависимости от проявляемого ими эффекта (мезомерного или индуктивного): электронодонорные и электроноакцепторные. Электронодонорные заместители проявляют +М- и +I-эффект и повышают электронную плотность в сопряженной системе. К ним относятся гидроксильная группа —ОН и аминогруппа —NН2. Неподеленная пара электронов в этих группах вступает в общее сопряжение с p -электронной системой бензольного кольца и увеличивает длину сопряженной системы. В результате электронная плотность сосредоточивается в орто- и пара-положениях:
|
|
|
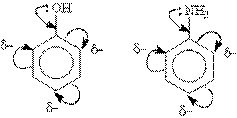
Алкильные группы не могут участвовать в общем сопряжении, но они проявляют +I-эффект, под действием которого происходит аналогичное перераспределение p -электронной плотности.
Электроноакцепторные заместители проявляют - М-эффект и снижают электронную плотность в сопряженной системе. К ним относятся нитрогрупла —NO2, сульфогруппа —SO3Н, альдегидная —СНО и карбоксильная —СООН группы.
Эти заместители образуют с бензольным кольцом общую сопряженную систему, но общее электронное облако смещается в сторону этих групп. Таким образом, общая электронная плотность в кольце уменьшается, причем меньше всего она уменьшается в мета-положениях:
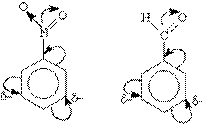
Полностью галогенизированные алкильные радикалы (например, —ССl3) проявляют -I-эффект и также способствуют понижению электронной плотности кольца.
Закономерности преимущественного направления замещения в бензольном кольце называют правилами ориентации.
Заместители, обладающие +I-эффектом или +М-эффектом, способствуют электрофильному замещению в орто- и пара-положениях бензольного кольца и называются заместителями (ориентантами) первого рода:
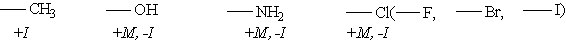
Заместители, обладающие -I-эффектом или -М-эффектом, направляют электрофильное замещение в мета-положения бензольного кольца и называются заместителями (ориентантами) второго рода:
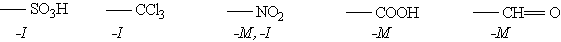
Так, толуол, содержащий заместитель первого рода, нитруется и бромируется в пара- и орто-положения:

Нитробензол, содержащий заместитель второго рода, нитруется и бромируется в мета-положение:
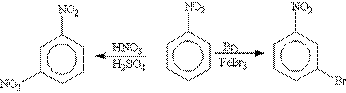
Помимо ориентирующего действия заместители оказывают влияние и на реакционную способность бензольного кольца: ориентанты 1-го рода (кроме галогенов) облегчают вступление второго заместителя; ориентанты 2-го рода (и галогены) затрудняют его.
|
|
|


