 |
Кинетика гомогенных каталитических реакций.
|
|
|
|
Общие понятия
Явление изменения скорости химической реакции под действием веществ, которые участвуя в промежуточных стадиях реакции в конце её остаются неизменными, называется катализом, а сами вещества катализаторами. Поскольку катализатор принимает участие на промежуточных стадиях, то он не в состоянии вызвать термодинамически невозможную реакцию, так как термодинамическая возможность протекания реакции определяется только конечным и начальным состоянием участников реакции. Различают гомогенные и гетерогенные каталитические реакции.
Реакции, в которых исходные вещества и катализатор находятся в одной фазе, называются гомогенными каталитическими реакциями, а само явление катализа -гомогенным катализом. Гомогенные химические реакции, как правило, протекают в газовой фазе или в растворе. В качестве примера гомогенной химической реакции можно привести реакцию превращения озона в кислород, протекающую в верхних слоях атмосферы:
С1(г)  + Оз (г) - СlO (г) + О2 (г) С1О(г)+ О(г)= С1(г) +О2(г)
+ Оз (г) - СlO (г) + О2 (г) С1О(г)+ О(г)= С1(г) +О2(г)
 О3(г) + О(г) = 2О2(г) (6.1)
О3(г) + О(г) = 2О2(г) (6.1)
В реакции (6.1) атомы хлора являются катализаторами. В гомогенном катализе различают ферментативный катализ, который наблюдается в гомогенных каталитических реакциях, где катализаторами являются ферменты. Ферменты - это вещества белковой природы, которые каталитически регулируют процессы жизнедеятельности в живой природе. Другими словами, ферменты - это биокатализаторы, которые синтезируются в живом организме.
Реакции, в которых исходные вещества и катализатор находятся в различных фазах, называются гетерогенными химическими реакциями, а само явление катализа гетерогенным катализом. Наиболее широкое распространение получили реакции, когда катализатор находится в твёрдой фазе, а реагирующие вещества в жидкой или газообразной фазах. Гетерогенная химическая реакция всегда протекает на поверхности твёрдого катализатора.
|
|
|
Если катализатор ускоряет химическую реакцию, то катализ называется положительным, если замедляет - отрицательным. Вещества, которые замедляют скорость химической реакции, называются ингибиторами.
Катализатор характеризуется каталитической активностью, под которой понимают изменение скорости химической реакции под действием катализатора:
А = ωк - ω0(1 -φ), (6.2)
где ωк и ω 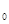 — скорости химической реакции в присутствии катализатора и без него соответственно;
— скорости химической реакции в присутствии катализатора и без него соответственно;
φ - доля объёма системы, занимаемая катализатором; А - активность катализатора. В большинстве случаев член ω 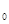 (1 -φ) несравнимо мал по отношению к ωк и им можно пренебречь. Тогда
(1 -φ) несравнимо мал по отношению к ωк и им можно пренебречь. Тогда
А 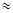 ωк. (6.3)
ωк. (6.3)
Различают также удельную активность катализатора. В гомогенном катализе под удельной активностью понимают каталитическую активность, отнесённую к количеству молей катализатора в единице объёма:
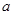 =
= 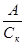
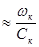 (6.4)
(6.4)
где Ск – концентрация катализатора.
В гетерогенном катализе удельной каталитической активностью катализатора называют активность, отнесённую к единице поверхности твёрдого катализатора:
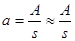 (6.5)
(6.5)
где s - площадь поверхности твёрдого катализатора.
Катализаторы характеризуются селективностью или избирательностью. Селективность катализатора - это его способность ускорять один из возможных путей реакции, если она может протекать по различным направлениям с образованием различных продуктов. Например, пары этилового спирта в присутствии металлического никеля разлагаются на водород и уксусный,
С6H5OH (г) = СН3СНО (г) + Н(г) (6.6)
а в присутствии Al2O3 - на этилен и воду
C6H5OH (г) = С2Н4 (г) + Н2О (г) (6.7)
Часто добавка некоторых веществ к катализатору в небольшом количестве, резко увеличивает его активность. Такие вещества называются промоторами или модификаторами, а сам катализатор промотированым. Различают структурообразующие и модифицирующие промоторы. Структурообразующие промоторы стабилизируют активную фазу катализатора по отношению к внешним воздействиям,не изменяя строение катализатора. Модифицирующие промоторы изменяют строение и химическийсостав активной фазы катализатора. От промотированных катализаторов следует отличать смешанные катализаторы, которые состоят из нескольких компонентов, каждый из которых обладает каталитической активностью к данной химической реакции.
|
|
|
Некоторые вещества, присутствующие в реакционной смеси даже в незначительном количестве, способны понижать активность катализатора. Такие вещества называются каталитическими ядами, а явление снижения активности - отравлением катализатора.
Снижение активности катализатора может быть вызвано старением катализатора, которое вызывается различными причинами: превращение мелкокристаллической структуры в процессе рекристаллизации в крупнокристаллическую с меньшей поверхностью; отложением на поверхности катализатора продуктов побочных реакций; изменением структуры и химического состава носителя и др.
При практическом использовании катализаторы зачастую наносят на поверхность твёрдых тел с развитой поверхностью. Такие тела называют носителями. К ним относятся древесный уголь, кокс, силикагель, алюмогель и др.
Кинетика гомогенных каталитических реакций.
Теория гомогенных химических реакций основана на следующих основных
положениях: 1) исходные вещества и катализатор образуют между собой неустойчивое промежуточное соединение; 2) образование промежуточного соединения является относительно быстрым процессом; 3) промежуточное соединение находится в равновесии с исходными веществами; 4) промежуточное соединение распадается на продукты
реакции и катализатор; 5) распад промежуточного соединения является относительно медленным процессом. Рассмотрим двумолекулярную химическую реакцию
А + В 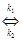 АВ
АВ 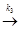 продукты + К (6.8)
продукты + К (6.8)
В присутствии катализатора реакцию (6.8) можно записать следующим образом:
|
|
|
А + В + К 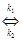 Z
Z 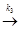 продукты + К, (6.9)
продукты + К, (6.9)
где К - катализатор; Z - промежуточное соединение исходных веществ с катализатором; k1 k2 и k3 -константы скоростей соответствующих реакций.
Скорость образования промежуточного соединения в соответствии с основным постулатом химической кинетики выражается уравнением:
ω1= k1CACBCK (6.10)
а скорость его распада уравнением:
ω2 = k2CZ (6.11)
Поскольку промежуточное соединение находится в равновесии с промежуточным соединением, то
ω1= ω2 (6.12)
или
k1CACBCK = k2CZ  (13)
(13)
Если начальная концентрация катализатора составляла Со и к какому-то моменту времени концентрация промежуточного соединения стала Cz, то концентрация катализатора Ск к этому моменту времени, как видно из уравнения реакции (6.9), составит Со - Cz.. С учётом этого уравнение (13) примет вид:
k1CACB(C0 – CZ) = k2CZ (14)
Тогда концентрация промежуточного соединения к данному моменту времени составит:
CZ = 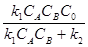 (15)
(15)
Скорость реакции (6.9) в целом определится скоростью наиболее медленной стадии распада промежуточного соединения:
ω = k 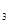 CZ =
CZ = 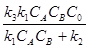 (16)
(16)
Таким образом, скорость гомогенной каталитической реакции пропорциональна концентрации катализатора.
Если скорость реакции образования промежуточного соединения намного превышает скорость обратной реакции (k2 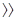 k1), то уравнение (16) принимает вид:
k1), то уравнение (16) принимает вид:
ω = k3C 0 (17)
В этом случае скорость реакции будет зависть только от концентрации катализатора. Если скорость распада промежуточного соединения на исходные вещества намного превышает скорость реакции его образования (k2» k1), то уравнение (6.16) принимает вид:
 ω =
ω = 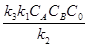 = k’CACBC0 (6.18)
= k’CACBC0 (6.18)
Скорость реакции в этом случае будет пропорциональна концентрации катализатора и концентрации реагирующих веществ.
В практике широкое распространение в водных растворах имеет кислотно-основной катализ, где роль катализатора играют ионы водорода и гидроксила. Это явление получает объяснение при рассмотрении кислот и оснований как веществ, способных обмениваться протонами. Здесь кислотой называется соединение, способное отдавать протоны, а основанием - соединение, способное принимать протоны. В этой модели кислота выступает как донор протонов, а основание как акцептор. Равновесие, устанавливающиеся в таких реакциях, называют кислотно - основным. В общем виде такую реакцию можно представить уравнением:
|
|
|
К + О = К++O- (6.19)
где К - исходная кислота; О - исходное основание; К+ - образующаяся кислота; О-- образующееся основание.
Согласно теории гомогенного катализа каталитические реакции, в которых кислота и основание выступают как катализаторы, можно записать в виде:
А + К 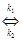 АН+ + О-
АН+ + О- 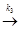 продукты + К (6.20) AH + O-
продукты + К (6.20) AH + O- 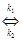 А- + К
А- + К 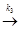 продукты + О-, (6.21)
продукты + О-, (6.21)
где k1, k2 и kз - константы скоростей соответствующих реакций
Роль катализатора в гомогенных каталитических реакциях сводится к изменению механизма протекания химической реакции, по сравнению с некаталитической. Катализатор переводит химическую реакцию на энергетически более выгодный путь, в результате чего энергия активации каталитической реакции меньше, чем некаталитической. Таким образом, роль катализатора в конечном итоге сводится к понижению энергии активации химической реакции.
|
|
|


