 |
Требования, предъявляемые к опорным конспектам.
|
|
|
|
Разработайте урок (или фрагмент урока) по изучению неметаллов с использованием опорных конспектов. Перечислите требования, предъявляемые к опорным конспектам. Какова методика работы опорными конспектами?
Опорный план-конспект при изучении нового материала по теме «Неметаллы».
Положение неметаллов в ПСХЭ.
Строение атомов неметаллов.
| III A | IV A | V A | VI A | VII A | VIII A | |||||||||||||||||||
| B 1s22s22p1 2p1 | C 1s22s22p2 2p2 | N 1s22s22p3 2p3 | O 1s22s22p4 2p4 | F 1s22s22p5 2p5 | Ne 1s22s22p6 2p6 | |||||||||||||||||||
| 2s2 | ↑ | 2s2 | ↑ | ↑ | 2s2 | ↑ | ↑ | ↑ | 2s2 | ↑↓ | ↑ | ↑ | 2s2 | ↑↓ | ↑↓ | ↑ | 2s2 | ↑↓ | ↑↓ | ↑↓ | ||||
| ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | |||||||||||||||||||
3.Кристаллическое строение неметаллов - простых веществ. Аллотропия.
| ПРОСТЫЕ ВЕЩЕСТВА НЕМЕТАЛЛЫ | ||
| СОСТАВ | СТРОЕНИЕ | СВОЙСТВА |
| Состоят из атомов неметаллических элементов с одинаковым значением ЭО, между которыми образуется ковалентная неполярная связь | Молекулярное | Газы, жидкости, твердые (хрупкие), низкие tпл. и tкип., мало растворимы в воде, не проводят эл. ток |
| Немолекулярное (атомное) | Очень твердые кристаллические вещества, очень высокие tпл. и tкип., не растворимы в воде, не проводят эл. ток |
4.Физические свойства неметаллов.
| Газообразное вещество | Твёрдое вещество | Жидкость |
| Ø водород ― H2; Ø азот ― N2; Ø кислород ― O2; Ø фтор ― F2; Ø хлор ― CI2; Ø гелий ― He; | Ø бор ― B; Ø углерод ― C; Ø кремний ― Si; Ø фосфор ― P; Ø сера ― S; Ø мышьяк ― As; Ø йод ― I; | бром ― Br2. |
|
|
|
Химические свойства неметаллов.
| Неметаллы как окислители | Неметаллы как восстановители |
| Ø с металлами: 2Na + Cl2 = 2NaCl; Ø с водородом: H2 + F2 = 2HF; Ø с неметаллами, которые имеют более низкую электроотрицательность: 2Р + 5S = Р2S5; Ø с некоторыми сложными веществами: 4NH3 + 5O2 = 4NO + 6H2O, 2FeCl2 + Cl2 = 2 FeCl3. | Ø (кроме фтора) S + O2 = SO2, 2H2 + O2 = 2H2О. Хлор непосредственно с кислородом не соединяется, но косвенным путем можно получить его оксиды (Cl2O, ClO2, Cl2O2), в которых хлор проявляет положительную степень окисления. Ø со сложными веществами: ZnO + C = Zn + CO, S + 6HNO3 конц = H2SO4 + 6NO2 + 2H2О. Ø Существуют и такие реакции, в которых один и тот же неметалл является одновременно и окислителем и восстановителем: Cl2 + H2О = HCl + HClO. |
В соответствии с численными значениями относительных электроотрицательностей окислительные способности неметаллов:
 Si, B, H, P, C, S, I, N, Cl, O, F
Si, B, H, P, C, S, I, N, Cl, O, F
УВЕЛИЧИВАЮТСЯ
Виды соединений неметаллов.

Водородные соединения неметаллов.
| Период | IA | IIIA | IVA | VA | VIA | VIIA | VIIIA |
| H-нет | |||||||
| B2Н6 | CН4 | NН3 | (ж)Н2O | НF | |||
| SiН4 | PН3 | Н2S | НCl | ||||
| AsН3 | Н2Se | НBr | |||||
| Н2Te | НI | ||||||
| НAt |
* -все газы, кроме воды.
кислоты основание амфотерное соединение
| I | II | III | IV | V | VI | VII |
| RH | RH2 | RH3 | RH4 | RH3 | H2R | HR |
| Нелетучие водородные соединения | Летучие водородные соединения |
Летучие водородные соединения неметаллов:
| Хорошо растворимые в воде (HCl, HBr, HJ, H2S, H2Se, NH3) | Соединения, разлагаемые водой | Летучие водородные соединения (CH4, PH3) |
диссоциируют на ионы, проявляя кислотные и основные свойства:
NH3 → H2O → HCl
осн. амф. кисл.
  HCl + H2O [ H3O ]+ +Cl- HCl + H2O [ H3O ]+ +Cl-
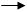  NH3 + H2O NH4++OH NH3 + H2O NH4++OH
| BH3 + 3H2O = H3BO3 +3H2↑ | не взаимодействуют с водой |
|
|
|
В периоде (ПСХЭ) с увеличением порядкового номера элемента – неметалла усиливается кислотный характер водородного соединения.
SiH4 → PH3 → H2S → HCl
Высшие оксиды неметаллов.
| Период | IA | IIIA | IVA | VA | VIA | VIIA | VIIIA |
| (ж) H2О | Инертные газы - нет | ||||||
| (тв)B2О3 | (г)CО2 | (тв)N2О5 | O - нет | F - нет | |||
| (тв)SiО2 | (тв)P2О5 | (тв)SО3 | (ж) Cl2О7 | ||||
| (тв)As2О5 | (тв)SeО3 | Br2О7-не сущ. | |||||
| (тв)TeО3 | I2О7-не сущ. | ||||||
| At - нет |
Высшие гидроксиды (кислоты).
| Период | IA | IIIA | IVA | VA | VIA | VIIA | VIIIA |
| H-нет | Инертные газы - нет | ||||||
| Н3BО3 | Н2CО3 | НNО3 | O-нет | F-нет | |||
| Н2SiО3 | Н3PО4 | Н2SО4 | НClО4 | ||||
| Н3AsО4 | Н2SeО4 | НBrО4 | |||||
| Н2TeО4 | Н5IО6 | ||||||
| НAt |
Требования, предъявляемые к опорным конспектам.
Опорный конспект – это развернутый план Вашего предстоящего ответа на теоретический вопрос. Он призван помочь Вам последовательно изложить тему, а преподавателю – лучше понимать Вас и следить за логикой Вашего ответа. Правильно составленный опорный конспект должен содержать все то, что в процессе ответа Вы намериваетесь рассказать. Это могут быть чертежи, графики, формулы (если требуется, с выводом),формулировки основных законов, определения.
ОК – образный план изложения материала, система ключевых слов, условных знаков, рисунков, символов, которые служат зрительной опорой для мыслительной деятельности человека.
Этапы составленияОК:
1.Анализ материала по теме, подбор содержания и разделение его на блоки информации. 2.Выделение в каждом блоке опорных сигналов, с которыми ассоциируется содержание понятий. 3.Расположение опорных понятий внутри блока в определенной логической последовательности. 4.Расположение блоков информации на листе бумаги в определенной последовательности. 5.Решение цветовой гаммы.
Требования к ОК: краткость, наглядность, минимум текста, полная запись новых терминов, не более 7 блоков информации, ассиметричность расположения, использование общепринятых символов.
Методика работы с ОК: 1.Развернутое, образное объяснение учителя отобранного для урока материала. 2.Сжатое изложение материала по ОК. 3.Работа учащихся с ОК. 4.Работа с ОК в домашних условиях. 5.Письменно воспроизвести ОК на уроке, тихий опрос. 6.Постоянное повторение и углубление знаний.
|
|
|
|
|
|


