 |
Рис.3.3. Изменение скоростей прямой ( и обратной ( реакций с течением времени (t)
|
|
|
|
Рис. 3. 3. Изменение скоростей прямой ( и обратной ( реакций с течением времени (t)
Начиная с момента равновесия, при неизменных внешних условиях концентрации исходных веществ и продуктов реакции не изменяются с течением времени. Концентрации реагентов, отвечающие состоянию равновесия, называются равновесными. Для определения равновесной концентрации реагента необходимо из его начальной концентрации вычесть количество вещества, прореагировавшего к моменту наступления равновесного состояния:
Сравн. = Сисх. – Спрореагир.
Количество реагентов, вступивших в реакцию и образовавшихся к моменту равновесия продуктов, пропорциональны стехиометрическим коэффициентам в уравнении реакции.
При постоянной температуре константы скоростей прямого и обратного процесса являются постоянными величинами.
Отношение констант скоростей прямой и обратной реакций является также величиной постоянной 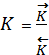 и носит название константа химического равновесия. Она может быть выражена через концентрации реагентов, а для реакций с участием газов через их парциальные давления.
и носит название константа химического равновесия. Она может быть выражена через концентрации реагентов, а для реакций с участием газов через их парциальные давления.
В общем виде для обратимой гомогенной реакции:
аА(г) + bВ(г) = сС(г) + dD(г)
при V, T = const
 = =  . .
| (3. 8) |
при Р, T = const  = = 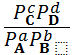 , ,
| (3. 9) |
где [A], [В], [С], [D] – равновесные концентрации веществ (моль/л);
рА, рВ, рC, рD – равновесные парциальные давления газов.
Уравнения (3. 8) и (3. 9) называются математическими выражениями констант равновесия.
Например, для гомогенной реакции:
H2(г) + I2(г) ⇄ 2HI(г),
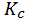 =[HI ] 2/[ H2 ][ I2] =[HI ] 2/[ H2 ][ I2]
 = = 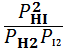 . .
|
Для гетерогенных процессов в выражение константы равновесия (3. 8) и (3. 9) конденсированные вещества в собственной фазе (например, Н2О(ж), NaСl(т) и т. п. ) не включаются.
|
|
|
Например, для гетерогенной реакции:
FeO(тв) + CO(г) ⇄ Fe(тв) + CO2(г) выражение константы равновесия будет иметь вид:

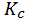 = [ CO2]/ [ CO]
= [ CO2]/ [ CO]
Учитывая соотношение между парциальным давлением и концентрацией, согласно уравнению Менделеева-Клайперона, Pi=CiRT, можно установить взаимосвязь между Кр и Кс:
| Kp = Kc(RT)Δ п, | (3. 10) |
где Dn – изменение числа молей газообразных веществ в ходе реакции, которое рассчитывается по формуле Dn = å ν газ. прод. - å ν газ. исх. веществ
Константа химического равновесия не зависит от пути протекания процесса и определяет глубину его протекания к моменту достижения равновесия. Чем больше эта величина, тем больше степень превращения реагентов в продукты.
Константа химического равновесия, так же, как и константы скоростей реакции, является функцией только температуры и природы реагирующих веществ и не зависит от их концентрации.
С ростом температуры в эндотермических процессах константа равновесия увеличивается, а экзотермических реакциях уменьшается.
4. 2. 1. Смещение химического равновесия
Состояние химического равновесия является устойчивым и в нем система обладает минимумом запаса свободной энергии. Это состояние может продолжаться сколь угодно долго при заданных условиях, т. е. пока параметры, при которых оно сформировалось, остаются неизменными. При изменении условий равновесие нарушится и сместится в ту или другую сторону. Через некоторое время в системе установится новое состояние равновесия, отвечающее новым условиям и новым равновесным концентрациям веществ. Сдвиг равновесия обусловлен тем, что изменение условий по - разному влияет на скорость прямой и обратной реакций. Если при изменении внешних условий скорость прямой реакции возросла больше, чем обратной, то равновесие смещается в сторону прямой реакции ˗ вправо, и наоборот.
|
|
|
Качественным принципом, позволяющим определить направление смещения химического равновесия, служит принцип Ле-Шателье: «Если на систему, находящуюся в состоянии равновесия, оказать какое-либо внешнее воздействие, то равновесие сместится в том направлении, при котором это воздействие уменьшается».
К основным факторам, способным повлиять на состояние химического равновесия, относятся температура и концентрация реагентов. Для реакций, протекающих с участием газов при постоянной температуре, дополнительным фактором является давление, так как его изменение приводит к изменению объема и, следовательно, к изменению концентрации газовых реагентов.
1. Влияние концентрации реагентов
С увеличением концентрации исходных веществ, скорость прямой реакции возрастает, поэтому равновесие смещается вправо, что увеличивает выход продуктов. К такому же эффекту приводит отвод продуктов из равновесной смеси. Увеличение концентрации продуктов реакции или уменьшение концентрации исходных веществ вызывает смещение равновесия влево, т. е. в сторону исходных веществ. При этом через некоторое время в системе опять установиться новое состояние равновесия.
2. Влияние температуры
Влияние температуры на смещение равновесия можно свести к следующему: если к равновесной системе, находящейся при постоянном давлении, подводить теплоту, то равновесие сместиться в сторону поглощения теплоты. И, наоборот, если теплоту отводить, то равновесие сместится в сторону выделения теплоты. Другими словами, в случае эндотермической реакции при нагревании равновесие смещается в сторону прямой реакции, т. е. вправо. А в случае экзотермической реакции нагревание смещает равновесия в сторону обратной реакции.
3. Влияние давления
При повышении давления (уменьшения объема реакционной системы) равновесие смещается в сторону меньшего количества молей газообразных веществ. И, наоборот, при уменьшении давления равновесие в системе смещается в сторону большего количества молей газообразных веществ. Если количество молей газообразных веществ в ходе реакции не меняется, то изменение давления не приводит к смещению равновесия.
|
|
|
Рассмотрим влияние этих факторов на смещение равновесия в реакции:
N2(г) + 3H2(г) ⇄ 2NH3(г), DН0х. р. = -92, 4кДж.
Увеличение концентрации N2 или H2 (исходных веществ) приводит к возрастанию скорости прямой реакции, поэтому равновесие смещается вправо, что увеличивает выход продуктов. При увеличении, продуктов (NH3) – влево.
Данная реакция экзотермическая (DН0х. р. < 0), нагревание препятствует протеканию прямой реакции, что приводит к смещению равновесия в сторону обратной реакции (влево).
При повышении давления равновесие смещается в направлении процесса, идущего с уменьшением количества молей газообразных веществ. В ходе данной реакции число молей газообразных веществ уменьшается (вступают 1моль N2 и 3моля H2, а образуется 2моля NH3). Повышение давления сместит равновесие в направлении процесса, идущего с уменьшением количества молей газообразных веществ, то есть вправо.
|
|
|


