 |
5.5. Равновесные процессы в растворах электролитов
|
|
|
|
5. 5. Равновесные процессы в растворах электролитов
Теория электролитической диссоциации позволила научно определить понятие кислоты и основания, объяснить процессы ступенчатой диссоциации, процесс гидролиза солей, создать теорию индикаторов и т. п.
5. 5. 1. Диссоциация кислот и оснований
Теория Аррениуса позволила сформулировать первую теорию кислот и оснований. Согласно ей, кислотой является соединение, диссоциирующее на катины водорода и кислотный остаток ( анион)
НАn ⇄ Н+ + An-.
Основание – это соединение, диссоциирующее на катионы металла и анионы гидроксида:
МeОН ⇄ Мe+ + ОН- .
Диссоциация многоосновных кислот протекает ступенчато, т. е. на каждой ступени происходит отщепление одного иона водорода. Число стадий равно основности кислоты – числу атомов водорода в составе кислоты.
Так, диссоциация ортофосфорной кислоты будет протекать в три стадии: 1 стадия: НЗРО4 ⇄ H+ + Н2РО4-, К1=7, 11∙ 10-3
2 стадия: H2PО4- ⇄ Н+ + НРО42-, К2=6, 34∙ 10-8
З стадия: НРО42- ⇄ Н++ РО43-, К3=4, 40∙ 10-13
Каждая из стадий характеризуется своей константой диссоциации. Каждая последующая константа примерно на 5 порядков меньше предыдущей, что свидетельствует о возрастании затрудненности процесса. Поэтому в разбавленных растворах фосфорной кислоты фосфат-ионов (РО43-) очень мало. Для многоосновных кислот в большинстве случаев процесс диссоциации ограничивается первой стадией.
Диссоциация многокислотных оснований также протекает стадийно, число стадий определяется кислотностью основания (числом ОН-˗ групп в составе молекулы основания).
Например, диссоциация гидроксида бария Ва(ОН)2 происходит в две стадии:
|
|
|
1 стадия: Ва(ОН)2 ⇄ ВаОН+ + ОН-, 2 стадия: ВаОН+ ⇄ Ва2+ + ОН-.
Диссоциация солей
Диссоциация солей определяется типом соли. Различают средние, кислые и основные соли.
Диссоциация средних солей – одностадийный процесс, в котором образуются катионы металла и анионы кислотного остатка. Например, при диссоциации сульфата алюминия в раствор переходят катионы алюминия и сульфат-анионы:
Al2(SO4)3 → 2Al3+ + 3 SO42-
Кислые соли содержат в своем составе незамещенные ионы водорода кислоты, поэтому их диссоциация протекает ступенчато: сначала до катиона металла и аниона кислоты, затем анион кислоты распадается на катион гидроксония и анион кислотного остатка. Например, гидрокарбонат натрия NaHCO3 – кислая соль угольной кислоты и гидроксида натрия диссоциирует в две стадии:
1 стадия: NaHCO3 ↔ Na+ + HCO3-,
2 стадия: HCO3- ↔ H+ + CO32-.
В состав основных солей входят незамещенные гидроксид-ионы, их диссоциация протекает ступенчато, на первой стадии с образованием гидроксо-катионов металла и аниона кислотного остатка. Например, диссоциация гидроксохлорида кальция CaOHCl – основной соли гидроксида кальция и соляной кислоты проходит двухступенчато:
1 стадия: CaOHCl ↔ CaOH+ + Cl-
2 стадия: CaOH+ ↔ Ca2+ + OH- .
Диссоциация воды. Водородный показатель
Чистая вода относится к разряду очень слабых электролитов. Диссоциация воды описывается уравнением:
2Н2О ⇄ Н3О+ + ОН-,
или в упрощенном виде:
Н2О ⇄ Н+ + ОН-
Константа диссоциации воды:
Кд =  = 1, 8∙ 10-16. = 1, 8∙ 10-16.
| (4. 11) |
Учитывая, что степень диссоциации воды a< < 1, можно считать, что [H2O]~const=55, 56 моль/л. Объединив эту константу с Кд, получаем новую: Кд ∙ [H2O] = const =Kw;
| или Kw = [H+][OH-] = 10-14. | (4. 12) |
Константа Kw – называется ионным произведением воды; Kw зависит только от температуры. С повышением температуры диссоциация молекул воды усиливается и Kw увеличивается (при 00С Kw = 10-14, 9; при 600С Kw = 10-13).
|
|
|
Учитывая, что носителем кислотных свойств являются ионы Н+, а основных ОН-, равенство концентраций этих ионов предполагает нейтральную среду:
[H+]= [OH-] = 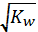 = 10-7 моль/л.
= 10-7 моль/л.
Для характеристики кислотности растворов введено понятие водородного показателя рН:
| pH = -lg [H+], | (5. 13) |
где [H+] – концентрация ионов водорода, моль/л.
Водородный показатель чистой воды равен: рН = - lg10-7= 7.
При стандартных условиях концентрация ионов водорода изменяется от 1 до 10-14 моль/л, а рН от 0 до 14. Для характеристики кислотности раствора применяется шкала рН:


 [H+], моль/л: 1 10-7 10-14
[H+], моль/л: 1 10-7 10-14

 0 7 14 рН
0 7 14 рН
[ОН-], моль/л: 10-14 10-7 1
При рН < 7 – среда кислая, рН = 7 – среда нейтральная, рН > 7 – среда щелочная.
Значение рН можно оценить с помощью индикаторов. Чаще всего индикаторы являются слабыми органическими кислотами или основаниями. Действие индикаторов основано на том, что диссоциированная и недиссоциированная формы индикатора имеют разную окраску. Например, фенолфталеин (слабая органическая кислота) в недиссоциированной форме – бесцветный, а в ионном виде – малиновый. Различают одноцветные (фенолфталеин) и двухцветные индикаторы (лакмус, метиловый оранжевый).
Для каждого индикатора существует определенный интервал рН изменения окраски. Вне этого интервала окраска индикатора практически не изменяется. В табл. 5. 1 представлены изменения окраски для некоторых индикаторов.
|
|
|


