 |
Рис. 7.2. Коррозия углеродистой стали в кислой среде
|
|
|
|
Рис. 7. 2. Коррозия углеродистой стали в кислой среде
Коррозионные процессы:
 Fe - 2e = Fe2+ 2Н+ + 2е = Н2 Fe +2H+ = Fe2+ + H2;
Fe - 2e = Fe2+ 2Н+ + 2е = Н2 Fe +2H+ = Fe2+ + H2;
б) нейтральная или щелочная среда (рН  7) в присутствии кислорода
7) в присутствии кислорода

Рис. 7. 3. Коррозия углеродистой стали в нейтральной и щелочной средах
Коррозионные процессы:
Fe - 2e = Fe2+ │ ∙ 2 О2 + 2Н2O + 4е = 4OН- │ ∙ 1 2Fe + O2 +2H2O = 2Fe2+ + 4OH- 2Fe2+ + 4OH- = 2Fe(OH)2.
Далее гидроксид железа (II) частично окисляется до гидроксида железа (III): 4Fe(OH)2 + O2 +2H2O = 4Fe(OH)3. С течением времени смесь гидроксидов Fe(OH)2 и Fe(OH)3 обезвоживается с образованием сложных гидратированных оксидов FeO· Fe2О3 · nH2O – так называемой ржавчины.
Геометрическая неоднородность поверхности связана с наличием шероховатости, наличием острых углов, граней, которые приводят к разным значениям энергии Гиббса на отдельных участках поверхности металла (сплава) и, следовательно, к разным значениям их потенциалов. На выступах количество оборванных связей у атома металла больше, чем во впадинах, и соответственно энергия Гиббса у такого участка будет больше, а потенциал поверхности меньше. Таким образом, выступ будет являться анодным участком.
|
|
|
Механические деформации (например, изгиб, провисание балки, напряженные сварные швы и т. д. ) за счет искажения кристаллической решетки металла приводят к образованию микрогальванопар. При этом в области растяжений металла возникает анодный участок, а в области сжатия – катодный. Коррозия при действии внешних и внутренних напряжений приводит к межкристаллитному растрескиванию.
Неоднородность состава среды может приводить к образованию микрогальванопар даже на поверхности одного и того же металла. Примером может служить коррозия металла под каплей воды (рис. 7. 4).
Так как поверхностные слои воды содержат больше растворенного кислорода, чем внутренние, поверхность металла в центре под каплей оказывается более активной (анодный участок), а на периферии капли будет возникать катодный участок металла. После высыхания капли в центре металлической пластинки появляется пятно ржавчины. Такие процессы наиболее часто наблюдаются при атмосферной и почвенной коррозии. В общем случае неоднородность состава среды приводит к неравенству электродных потенциалов на различных участках поверхности металла, что способствует образованию микрогальванопар.
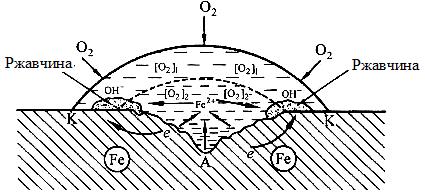
Рис. 7. 4. Коррозия железа под каплей воды
Контакт двух различных металлов, находящихся в растворе электролита, приводит к возникновению макрогальванопары. На рис. 8. 5 показана коррозия железа, находящегося в контакте с медью. В данной гальванопаре железо является анодом (Е°= -0, 44 В), а медь – катодом (Е°= 0, 337 В). Анодный процесс будет представлять собой окисление железа, катодный же будет определяться видом и составом коррозионной среды.

Рис. 7. 5. Коррозия при контакте двух металлов
|
|
|
Кинетика коррозионных процессов и факторы,
влияющие на скорость коррозии
Электрохимическая коррозия протекает через несколько взаимосвязанных стадий: движение электронов в металле, движение ионов в растворе, реакция анодного окисления металла и катодное восстановление окислителя. В целом скорость определяется самой медленной стадией, называемой лимитирующей.
При коррозии с водородной деполяризацией, ввиду большой подвижности ионов Н+, скорость процесса определяется скоростью реакции их восстановления, которая существенно зависит от природы металла, на котором она протекает. Влияние природы металла можно оценить по перенапряжению водорода (  Н2) на различных металлах. Чем меньше
Н2) на различных металлах. Чем меньше  Н2, тем быстрее протекает коррозия. Например, если в составе металла содержатся платина, золото или палладий, которые будут являться катодными участками, а перенапряжение водорода соответственно на них невелико, то скорость коррозии резко возрастает.
Н2, тем быстрее протекает коррозия. Например, если в составе металла содержатся платина, золото или палладий, которые будут являться катодными участками, а перенапряжение водорода соответственно на них невелико, то скорость коррозии резко возрастает.
Другие металлы, например, ртуть, свинец, цинк, кадмий не катализируют выделение водорода и катодный процесс протекает на них медленно. Например, цинк (Е0Zn2+/Zn = -0, 763 В) термодинамически неустойчив в кислых средах, но из-за большого перенапряжения выделения водорода (  Н2= -1, 24 В), цинк очень медленно вытесняет водород из кислот. Соприкосновение цинка и менее активного металла с меньшим
Н2= -1, 24 В), цинк очень медленно вытесняет водород из кислот. Соприкосновение цинка и менее активного металла с меньшим  Н2 (например, с медью) резко активизирует процесс коррозии цинка. При таком контакте возникает коррозионный гальванический элемент (Zn | H+ | Cu), в котором медь (Е0Cu2+/Cu =+0, 337 В) становится катодом. Перенапряжение выделения водорода на меде составляет
Н2 (например, с медью) резко активизирует процесс коррозии цинка. При таком контакте возникает коррозионный гальванический элемент (Zn | H+ | Cu), в котором медь (Е0Cu2+/Cu =+0, 337 В) становится катодом. Перенапряжение выделения водорода на меде составляет  Н2= =-0, 87 В, что существенно облегчает катодный процесс, в результате скорость анодного растворения цинка возрастает.
Н2= =-0, 87 В, что существенно облегчает катодный процесс, в результате скорость анодного растворения цинка возрастает.
Скорость восстановления кислорода также характеризуется его перенапряжением (  О2, В), т. е. степенью затрудненности процесса на данном металле. Чем меньше перенапряжение, тем больше скорость реакции восстановления кислорода и тем быстрее протекает коррозия металла.
О2, В), т. е. степенью затрудненности процесса на данном металле. Чем меньше перенапряжение, тем больше скорость реакции восстановления кислорода и тем быстрее протекает коррозия металла.
 оксидов, гидроксидов, солей. Например, алюминий на воздухе покрывается очень тонкой, но прочной оксидной плёнкой, после чего окисление практически прекращается. Оксидная пленка на железе является пористой и рыхлой, через нее происходит диффузия кислорода к поверхности металла и процесс коррозии продолжается. Это объясняет тот факт, что скорость коррозии алюминия в атмосферных условиях значительно меньше скорости коррозии железа, хотя стандартный электродный потенциал алюминия намного более отрицателен. В результате пассивации кислородом прочные, хорошо сцепленные оксидные пленки образуются также на титане, цинке и некоторых других металлах.
оксидов, гидроксидов, солей. Например, алюминий на воздухе покрывается очень тонкой, но прочной оксидной плёнкой, после чего окисление практически прекращается. Оксидная пленка на железе является пористой и рыхлой, через нее происходит диффузия кислорода к поверхности металла и процесс коррозии продолжается. Это объясняет тот факт, что скорость коррозии алюминия в атмосферных условиях значительно меньше скорости коррозии железа, хотя стандартный электродный потенциал алюминия намного более отрицателен. В результате пассивации кислородом прочные, хорошо сцепленные оксидные пленки образуются также на титане, цинке и некоторых других металлах. Вещества, способствующие образованию защитных пленок на поверхности металла, называются пассиваторами. К ионам-пассиваторам относятся, например, анионы PO43-, Cr2O72-, NO2-. При этом ионы Cr2O72-, NO2- являются хорошими окислителями и пассивируют поверхность металла путем создания на нем окисных пленок, а ион PO43- способствует образованию нерастворимых фосфатных пленок. К сильным пассиваторам относятся некоторые концентрированные кислоты-окислители, например, HNО3.
|
|
|
К основным факторам, влияющим на скорость коррозии, относятся:
1. Кислотно-щелочность (рН) коррозионной среды. Реакция среды, т. е. рН раствора, прежде всего, влияет на растворимость оксидных и гидроксидных пленок. По химическим свойствам эти пленки могут обладать основными, кислотными или амфотерными свойствами. В том случае, если пленки обладают основными свойствами, защитное действие их будет в большей степени проявляться в щелочных средах, где растворимость их меньше. Если оксидные или гидроксидные пленки металлов обладают кислотными свойствами, коррозионная устойчивость металлов будет в большей степени проявляться в кислых средах. В соответствии с этим все металлы можно разделить на следующие группы:
а) металлы, неустойчивые в кислых, но коррозионно-стойкие в щелочных средах (Ni, Co, Cd, Mg, Mn, Fe);
|
|
|
б) металлы, коррозионно-стойкие в кислых, но не устойчивые в щелочных растворах (Ta, Mo, W);
в) металлы, коррозионно-стойкие в нейтральных растворах, но неустойчивые в кислых и щелочных средах (Zn, Al, Sn, Pb, Bi, Be). У этих металлов защитные слои имеют амфотерный характер;
г) металлы, скорость коррозии которых практически не зависит от рН среды (Ag, Au, Pt). Это связано с тем, что указанные металлы не окисляются кислородом даже при нагревании, поэтому на них отсутствуют оксидные пленки.
2. Cостав коррозионной среды.
а) присутствие в электролите ионов Cl-, Br- способствует коррозии многих металлов. Ионы хлора хорошо адсорбируются на таких металлах, как Fe, Cr, Al, Ni и разрушают оксидные пленки, способствуя окислению металла. Именно этим объясняется быстрое разрушение многих металлов в морской воде. Ионы, способствующие коррозии называют депассиваторами.
б) полярные молекулы NH3 или ионы CN- также способны растворять оксидные пленки и образовывать с ионами металла комплексные соединения. В результате этого скорость коррозии резко возрастает. Например, медь, коррозионно-устойчивый металл, в растворе аммиака корродирует с достаточно большой скоростью:
2Cu + O2 + 8NH4OH = 2[Cu(NH3)4](OH)2 + 6H2O.
Увеличение скорости коррозии связано с тем, что комплексообразование увеличивает восстановительную активность металла за счет сдвига его потенциала в отрицательную сторону:
E0Cu/Cu2+ = +0, 337B; E0[Cu(NH3)4]2+/Cu = -0, 04 B.
Частица способные усиливать коррозию называются активаторами коррозии;
в) наличие в электролите гидролизующихся солей способно изменить рН раствора и тем самым повлиять на растворимость оксидных и солевых поверхностных пленок металла, а, следовательно, и на скорость коррозии.
3. Температура. Влияние температуры на скорость коррозии неоднозначно. Если процесс идет с кислородной деполяризацией, то с ростом температуры уменьшается растворимость кислорода, а следовательно, его концентрация, что приводит к снижению скорости коррозии. В случае коррозии с водородной деполяризацией с увеличением температуры скорость катодного выделения водорода возрастает, что способствует коррозии металлов.
Химически чистые металлы в меньшей степени подвергаются коррозии.
|
|
|


