 |
2. 2. Електрогравіметрія. Теоретичні основи методу. Список літератури
|
|
|
|
2. 2. ЕЛЕКТРОГРАВІМЕТРІЯ
Теоретичні основи методу
Електрогравіметричний аналіз є різновидом гравіметричного (вагового) методу. Він заснований на кількісному виділенні визначуваної речовини на електродах (наприклад, металів, їх окислів або солей), внаслідок використання електролізу аналізованого розчину, i вимірюванні маси отриманого на електроді осаду. Осаджувачем у цьому методі є електричний струм.
В процесі електролізу на катоді проходить відновлення позитивно заряджених іонів:
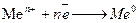
а на аноді - окиснення аніонів:

Наприклад, при електролізі розчину ZnCl2 на катоді виділяється цинк, а на аноді - хлор:

В інших випадках електроліз перебігає більш складно. Наприклад, при електролізі розчинів сульфатів лужних і лужноземельних металів на катоді виділяється водень:
 ,
,
а на аноді окислюється вода з виділенням кисню:

Електрогравіметрія використовується для розв'язання багатьох задач:
1. Для визначення катіонів, що відновлюються на катоді - Cu2+, Ni2+, Zn2+, Cd2+, тощо;
2. Для визначення катіонів, що окислюються на аноді – Pb2+ ( 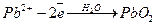 ) і Mn2+;
) і Mn2+;
3. Для визначення аніонів - Cl- (для цього використовують розчинний срібний анод;
4. Неметалічні включення в сталях - зразок, що аналізується підключається у вигляді аноду, метали розчиняються і переходять в розчин, а зважують неметалічний залишок каркасу;
5. Електроліз є основою полярографічного методу, амперметрії і кулонометрії;
6. Електроліз широко використовується для покриття різноманітних виробів захисним шаром металу.
Під час електрогравіметрічного аналізу силу струму підтримують постійною, регулюючи при цьому напругу джерела струму.
|
|
|
Без домішок і кількісно осадити визначуваний елемент можна, точно розрахувавши мінімальне значення накладеної ЕРС та максимальну напругу джерела струму.
Рівняння Нернста визначає залежність рівноважного потенціалу, який виникає на межі метал-розчин добре розчинної солі даного металу від концентрації іонів у розчині:

Напругу, необхідну для електролізу, розраховують за формулою
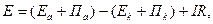
де  рівноважні потенціали анода і катода, які розраховані за рівнянням Нернста, В;
рівноважні потенціали анода і катода, які розраховані за рівнянням Нернста, В; 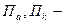 перенапруга на катоді і аноді, В;
перенапруга на катоді і аноді, В; 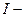 сила струму, А;
сила струму, А; 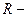 опір кола, Ом.
опір кола, Ом.
Масу речовини, яка відновлюється на катоді або окислюється на аноді, визначають за законом Фарадея:
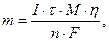
де 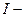 сила струму, А;
сила струму, А; 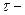 час електролізу, с;
час електролізу, с;  молярна (атомна) маса, г/моль;
молярна (атомна) маса, г/моль;
Ця залежність лежить в ocнoвi електрогравіметричного методу аналізу.
СПИСОК ЛІТЕРАТУРИ
1. Супрунович В. І., Плаксієнко І. Л., Шевченко Ю. І. Електрохімічні методи аналізу. Дніпропетровськ, УДХТУ, 2006. – 413 с.
2. Ляликов Ю. С. Физико-химические методы анализа. М.: Химия, 1974. 537 с.
3. Васильев В. П. Аналитическая химия. – М.: Высш. шк., 1989. – Кн. 1. – 320 с. – Кн. 2. – 384с.
4. Бабко А. К. и др. Физико-химические методы анализа. М.: «Высшая школа», 1968. 335 с.
5. Методические указания к лабораторному практикуму по физико-химическим методам анализа (электрохимические методы) для студентов III курса всех технологических специальностей / Сост.: Е. А. Нечаев, В. И. Супрунович, Л. Н. Нашиванько. – Днепропетровск: ДХТИ, 1989. – 48 с.
6. Методичні вказівки до лабораторного практикуму з аналітичної хімії. “Електрогравіметричний (електроваговий) аналіз” для студентів ІІІ курсу технологічних спеціальностей / Укл.: В. І. Супрунович, Н. Г. Федорова, Ю. І. Шевченко, Дніпропетровськ: УДХТУ, 1997. – 19 с.
7. Методичні вказівки до лабораторного практикуму з фізико-хімічних методів аналізу “Електрогравіметричний та кулонометричний методи” для студентів ІІІ курсу технологічних спеціальностей / Укл.: В. І. Супрунович, Н. Г. Федорова, Ю. І. Шевченко. – Дніпропетровськ: УДХТУ, 1999. – 28
|
|
|
|
|
|


