 |
Свойства растворов неэлектролитов
|
|
|
|
Температура замерзания (кристаллизации) раствора ниже температуры замерзания (кристаллизации) чистого растворителя, а температура кипения раствора выше температуры кипения растворителя.
Понижение температуры замерзания и повышение температуры кипения растворов по сравнению с чистым растворителем определяют по II закону Рауля:
Dtзам. = Кк×Сm; Dtкип. =Кэ×Cm,
где Dtзам. и Dtкип. – соответственно понижение температуры замерзания и повышение температуры кипения раствора находят по формуле
Dtзам = Тзам. р-ля – Тзам. р-ра ; Dtкип= Ткип. р-ра – Т кип. р-ля;
Кк и Кэ – соответственно криоскопическая и эбулиоскопическая константы растворителя; Сm – моляльная концентрация раствора (моль/кг) может быть найдена по формуле
 ,
,
где m1 – масса растворенного вещества, г; М – его молярная масса, г/моль; m2 – масса растворителя, г.
Осмотическое давление раствора неэлектролита определяют согласно закону Вант-Гоффа:

 ,
,
где n – количество растворенного вещества, моль; V – объем раствора, м3; R – газовая постоянная, равная 8,31 Дж/(моль·К); Т – температура, К; m – масса растворенного вещества, г; M – его молярная масса, г/моль; См - молярная концентрация, моль/л
Пример 1. Раствор, содержащий 11,04 г глицерина в 800 г воды, кристаллизуется при -0,279°С. Вычислите молярную массу глицерина.
Решение. Температура кристаллизации чистой воды 00С, следовательно, понижение температуры кристаллизации ∆T = 0 - (- 0,279) = 0,279°. Масса глицерина m (г), приходящаяся на 1000 г воды, равна:
M = 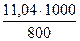 = 13,8 г
= 13,8 г 
Подставляя в уравнение M = K 
числовые значения, вычисляем молярную массу глицерина:
М =  = 92 г/моль.
= 92 г/моль.
Пример 2. Вычислите осмотическое давление раствора, содержащего в 1,4 л 63 г глюкозы C6H12O6 при 0 °С.
|
|
|
Решение. Молярная масса глюкозы составляет 160 г/моль, следовательно, в 1,4 л раствора содержится количество вещества глюкозы
 .
.
Осмотическое давление этого раствора глюкозы равно
 .
.
Дж = Па ∙ м3; 1л = 10 –3 м3.
Таблица 1.
Криоскопические и эбуллиоскопические константы растворителей
| Растворитель | Формула | tпл, 0C | Tкип, 0C | Кк | Кэ |
| Анилин | C6H5NH2 | -5,96 | 184,3 | 5,87 | 3,69 |
| Ацетон | CH3COCH3 | –94,6 | 2,4 | 1,48 | |
| Бензол | C6H6 | 5,4 | 80,2 | 5,1 | 2,57 |
| Вода | H2O | 1,86 | 0,516 | ||
| Камфора | С10H16O | 6,09 | |||
| Метиловый спирт | CH3OH | – | – | 0,84 | |
| Нафталин | C10H8 | 80,1 | 6,89 | 5,8 | |
| Нитробензол | C6H5NO2 | 5,82 | 210,9 | 8,1 | 5,27 |
| Сероуглерод | CS2 | – | 46,3 | – | 2,34 |
| Уксусная кислота | CH3COOH | 16,65 | 118,5 | 3,9 | 3,14 |
| Фенол | C6H5OH | – | 182,1 | – | – |
| Хлороформ | CHCl3 | -63,2 | 61,12 | 4,90 | 3,8 |
| Этиловый спирт | C2H5OH | – | 77,4 | – | 1,2 |
| Эфир (диэтиловый) | (C2H5)2O | -117 | 34,6 | 1,79 | 2,02 |
Задание: вычислить молярную массу растворенного вещества, используя данные таблицы 1.
| № задачи | Растворенное вещество | Растворитель | Dt | Температура замерзания р-ра, °С | ||
| Название | Масса, г | Название | Масса, г | |||
| Неэлектролит Нафталин Неэлектролит Сера Спирт Спирт Неэлектролит Этиловый спирт Мочевина Сера | 0,2 3,24 15% 6,55 1,05 8,74 0,162 | Бензол Вода Диэтиловый эфир Бензол Вода Вода Вода Вода Вода Бензол | 0,318 0,453 0,81 0,081 | -1,45 -10,26 -0,53 -0,7 -0,354 -3,72 |
| № задачи | Растворенное вещество | Растворитель | Dt | | темп-pa кипения р-ра, °С | |||
| название | масса, г | Название | масса, г | р-ра | p-ля | ||
| Фосфор Сера Глицерин Фенол Хлороформ Сера Йод Глицерин Неэлектролит Неэлектролит | 1,08 5,12 9,2 0,94 0,81 12,7 2,3 55,4 0,062 моль | Сероуглерод Бензол Ацетон Этиловый спирт Диэтиловый эфир Бензол Этиловый спирт Ацетон Вода Вода | 2,5 л 200 мл | 0,47 4,1 0,232 0,635 0,081 | 56,38 79,59 56,73 100,16 100,16 | 78,3 56,3 |
|
|
|
Задание: вычислить осмотическое давление водных растворов неэлектролитов
| № задачи | Неэлектролит | Содержание | Объем раствора | Температура | Формула |
| – | 0,2 моль/л | - | |||
| – | 0,15 моль | 2л | |||
| – | 0,02 моль/л | - | |||
| – | 0,04 моль/л | - | |||
| сахар | 91 г | 1л | C12H22O11 | ||
| глицерин | 46г | 3л | С3H5(OH)3 | ||
| сахар | 68,4г | 3л | C12H22O11 | ||
| анилин | 3,72г | 1л | C6H5NH2 | ||
| глицерин | 0,736г | 0,4л | С3H5(OH)3 | ||
| глюкоза | 90,08г | 4л | C6H12O6 | ||
| сахар | 3г | 5 л | C12H22O11 | ||
| глицерин | 4г | 2 л | С3H5(OH)3 | ||
| метиловый спирт | 3г | 1л | CH3OH | ||
| фенол | 0,1г | 2л | C6H5OH | ||
| глюкоза | 63г | 1,4л | C6H12O6 | ||
| - | 0,5 моль | 2 л | |||
| - | 0,25 моль | 1 л | |||
| - | 0,05 моль | 3 л | |||
| глицерин | 3г | 2 л | С3H5(OH)3 | ||
| - | 2 моль/л | - |
КОЛЛОИДНЫЕ РАСТВОРЫ
Пример 1. Для золя, полученного по реакциям:
1) AgNO3(изб) + KI→ AgI + KNO3 2) AgNO3 + KI(изб) → AgI + KNO3 указать: а) заряд коллоидной частицы
б) потенциалопределяющий ион
в) противоионы
г) внесением катионов или анионов электролита можно вызвать коагуляцию?
Решение. Коллоидные растворы это гетерогенная система, состоящая из множества мелких частиц какого–либо вещества, находящихся во взвешенном состоянии в однородной среде. Золи - жидкие коллоидные системы с частицами дисперсной фазы (мицеллами), свободно и независимо друг от друга перемещающимися в процессе броуновского движения. Процесс укрупнения частиц, потеря агрегативной устойчивости золя называется коагуляцией. Коагуляция золя приводит к потере его кинетической устойчивости, которая выражается в образовании осадка.
По таблице 2 «Растворимость важнейших солей в воде» определяем, что золем является AgI↓.
1) AgNO3(изб) + KI→ AgI + KNO3
а) Ядро состоит из электронейтрального агрегата частиц с адсорбированными ионами элементов, входящих в состав ядра (Ag+). После образования коллоидного раствора останется избыток Ag+ и NO3-. Так как в состав AgI↓ входит Ag+, то именно Ag+ будет адсорбироваться на поверхности, благодаря чему поверхность приобретет положительный заряд.
|
|
|

б) Специфически адсорбирующиеся ионы (Ag+) называют потенциалопределяющими: от них зависят знак и величина потенциала поверхности.
в) К положительно заряженной поверхности притягиваются противоионы NO3-. Адсорбированные ионы и противоионы с растворителем образуют адсорбированный слой. Суммарно заряд частицы равен разности зарядов адсорбированных ионов и противоионов. Вокруг частиц находится диффузный слой ионов, заряд которых равен заряду коллоидной частицы. Коллоидная частица и диффузный слой образуют электронейтральную мицеллу.
г) Коагуляцию можно вызвать, устранив одноименный заряд коллоидной частицы и защитную гидратную оболочку. Этого можно достигнуть путем введения в коллоидную систему электролита, имеющего противоионы по отношению к заряженным коллоидным частицам. При этом противоионы полностью нейтрализует заряд потенциалопределяющих ионов, т. е. коллоидная частица станет незаряженной. Гидратная оболочка частицы в значительной мере разрушается, и коллоидные частицы становятся незащищенными, при столкновениях слипаются, укрупняются. В нашем случае противоионами являются NO3- то есть анионы электролита.
2) AgNO3 + KI(изб) → AgI + KNO3
а) После образования коллоидного раствора останется избыток К+ и I-. Так как в состав AgI↓ входит I-, то именно I- будет адсорбироваться на поверхности, благодаря чему поверхность приобретет отрицательный заряд.
б) В нашем случае ионы I- называют потенциалопределяющими.
в) К отрицательно заряженной поверхности притягиваются противоионы К+.
г) Коагуляцию можно вызвать внесением противоионов, т. е. катионов электролита.
Задание: указать для золя, полученного по заданной реакции:
а) заряд коллоидной частицы
б) потенциалопределяющий ион
в) противоионы
г) внесением катионов или анионов электролита можно вызвать коагуляцию?
| № задачи | Уравнение реакции |
| Ba(NO3)2(изб) + Na2SO4→ BaSO4 + 2NaNO3 | |
| BaCl2(изб) + H2SO4 → BaSO4 + 2HCl | |
| BaCl2 + H2SO4(изб) → BaSO4 + 2HCl | |
| AgNO3 + NaCl(изб) → AgCl + NaNO3 | |
| AgNO3(изб) + NaCl → AgCl + NaNO3 | |
| Ba(NO3)2 + Na2SO4(изб) → BaSO4 + 2NaNO3 | |
| Ba(NO3)2(изб) + Na2SO4→ BaSO4 + 2NaNO3 | |
| Na2CО3(изб) + MgSO4→ Na2 SO4 + Mg CО3 | |
| Na2CО3 + MgSO4(изб)→ Na2 SO4 + Mg CО3 | |
| СаSO4 + К2CО3(изб)+ → СаCО3 + К2 SO4 | |
| СаSO4 (изб) + К2CО3+ → СаCО3 + К2 SO4 | |
| BaCl2 + Na2SO4(изб) → BaSO4+ 2NaCl | |
| BaCl2(изб) + Na2SO4 → BaSO4+ 2NaCl | |
| СаSO4 (изб) + К2CО3+ → СаCО3 + К2 SO4 | |
| MgSO4 + Na2CО3(изб) → MgCО3 + Na2 SO4 | |
| Na2CО3 + MgSO4(изб)→ Na2 SO4 + MgCО3 | |
| BaCl2 + Na2SO4(изб) → BaSO4 + 2NaCl | |
| BaCl2(изб) + Na2SO4 → BaSO4 + 2NaCl | |
| NaCl(изб) +AgNO3 → NaNO3 + AgCl | |
| AgNO3(изб) + NaCl → AgCl + NaNO3 |
|
|
|
|
|
|


