 |
Строение нуклеиновых кислот. Репликация
|
|
|
|
Нуклеиновые кислоты – высокомолекулярные органические соединения, обеспечивающие хранение и передачу генетической информации в живых организмах. Впервые были описаны в 1869 году Фридрихом Мишером. В природе существуют нуклеиновые кислоты двух типов – ДНК и РНК.
Среди нуклеотидов выделяют аденин, гуанин, тимин, цитозин и урацил – азотистые основания, они представлены на рисунке 4.1.

Рисунок 4.1. Азотистые основания
Нуклеотиды – это мономеры нуклеиновых кислот (рис. 4.2.). Нуклеиновые кислоты в эукариотических клетках находятся в ядре. Мономеры, из которых потом строятся нуклеиновые кислоты, состоят из азотистого основания, остатка сахара (дезоксирибоза или рибоза) и фосфата. Сахара вместе с азотистым основанием называются нуклеозидами (аденозин, гуанозин, тимидин, цитидин). Если к ним присоединены 1-, 2-, или 3-фосфорных остатка, то вся эта структура называется соответственно, нуклеотизид монофосфатом, дифосфатом или трифосфатом или нуклеотидом (аденин, гуанин, тимин, цитозин).
Азотистое основание, входящее в состав ДНК делится на две группы – пиримидиновую и пуриновую. В состав ДНК входит аденин, тимин, цитозин и гуанин, в РНК вместо тимина урацил. Как известно, ДНК – это большой архив, в котором хранится информация, а РНК – это молекула, которая переносит информацию из ядра в цитоплазму для синтеза белков. С различием в функциях связаны различия в строении.
НК более химически активна из-за того, что ее сахар - рибоза – имеет в своем составе гидроксильную группу, а в дезоксирибозе кислорода нет. Из-за отсутствия кислорода ДНК более инертно, что важно для ее функции хранения информации, чтобы она не вступала ни в какие реакции.
|
|
|


Рисунок 4.2. Строение нуклеотидов
Нуклеотиды способны взаимодействовать друг с другом, при этом "выбрасывается" два фосфора, и между соседними нуклеотидами образуется связь. В молекуле фуранозы молекулы углерода пронумерованы. С первым связано азотистое основание. Когда образуется цепочка нуклеотидов, связь осуществляется между пятым углеродом одной и третьим углеродом другой фосфорной кислоты. Поэтому в цепочке нуклеиновых кислот выделяют разные неравнозначные концы, относительно которых молекула не симметрична (рис. 4.3.).

Рисунок 4.3. Полинуклеотидная цепь ДНК
Комплементарные друг другу одноцепочечные молекулы нуклеиновой кислоты способны образовывать двуцепочечную структуру (рис. 4.4.). Внутри этой спирали аденин образует пару с тимином, а гуанин - с цитозином.
Однако нуклеотиды способны образовывать пары как угодно. Единственная причина, по которой они соединяются так, и никак иначе, заключается в том, что угол между "хвостиками", которые идут к сахарам, совпадает только в этих парах, и, кроме того, совпадают их размеры. Никакая другая пара не образует такой конфигурации. А поскольку они совпадают, то их через сахаро-фосфатный остов можно связать друг с другом. Структуру двойной спирали открыли в 1953 году Джеймс Уотсон и Фрэнсис Крик.
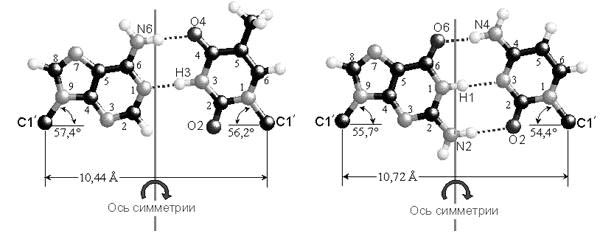
Рисунок 4.4. Комплементарное взаимодействие между нуклеотидами
При соединении друг с другом против 5’-конца одной нити находится 3’-конец другой нити. То есть нити идут в противоположных направлениях – нити в ДНК антипараллельны. На рисунке видно, что аденин соединяется с тимином двумя водородными связями, а гуанин соединяется с цитозином тройной водородной связью. Если молекулу ДНК подогревать, то ясно, что две связи легче разорвать, чем три, это существенно для свойств ДНК.
В силу пространственного расположения сахаро-фосфатного остова и нуклеотидов, когда нуклеотиды накладывают один на другой и "сшивают" через сахаро-фосфатный остов, цепочка начинает заворачиваться, тем самым образуя знаменитую двойную спираль (рис. 4.5.). Внутри спирали имеются бороздки: маленькая и большая. Через эти бороздки с ДНК взаимодействуют белки и распознают там последовательность нуклеотидов.
|
|
|
При нагревании ДНК водородные связи разрываются и нити в двойной спирали расплетаются. Процесс нагревания называется плавлением ДНК, при этом разрушаются связи между парами А-Т и Г-Ц.Чем больше в ДНК пар А-Т, тем менее прочно нити друг с другом связаны, тем легче ДНК расплавить.


Рисунок 4.5. Двойная спираль ДНК
Переход из двухспиральной ДНК в одно-спиральную измеряется на спектрофотометрах по поглощению света при 260 нм. Температура плавления ДНК зависит от А-Т/Г-Ц состава и размера фрагмента молекулы.
Молекула ДНК, состоящая из двух спиралей, удваивается при делении клетки. Удвоение ДНК основано на том, что при расплетении нитей к каждой нити можно достроить комплементарную копию, таким образом, получая две нити молекулы ДНК, копирующие исходную. Репликация ДНК происходит полуконсервативным путем (рис. 4.6.).

Рисунок 4.6. Реплицирующаяся молекула ДНК
В процессе репликации участвует целый ряд ферментов с определенными функциями. Их называют ДНК- полимеразами I, II и III. Сведения о функциональных особенностях ДНК-полимераз приведены в таблице 4.1. Основная функция полимеразы III- синтез цепи, полимеразы I- синтез и исправление ошибочно вставленных нуклеотидов. Полимераза II осуществляет особые, специализированные функции.
Таблица 4.1.
ДНК- зависимые ДНК-полимеразы
| Проявляемая функция (активность) | Полимераза | |||||
| Pol I | Pol II | Pol III | Фрагмент Кленова | |||
| Полимеразная 5'-3' | есть | есть | есть | есть | ||
| Экзонуклеазная 3'-5' | есть | есть | есть | есть | ||
| Экзонуклеазная 5'-3' | есть | нет | нет | нет | ||
Репликация начинается с расплетания цепей ДНК специальными расплетающими белками, которые называют геликазами (Rep-протеином). Геликазы используют энергию АТФ в процессе расплетания цепей. Скорость расплетания составляет около 6000 мин-1. Для того чтобы расплетенные цепи не могли вновь соединиться, имеются специальные SSB-белки (single-strand binding proteins), которые присоединяются к комплементарным цепям, удерживая их от ассоциации. Структура, которая образуется во время репликации, называется репликативной вилкой (рис. 4.7.).
|
|
|
Процесс репликации происходит с большой точностью, но не абсолютной. Бактериальная ДНК-полимераза делает ошибки, то есть вставляет не тот нуклеотид, который был в матричной молекуле ДНК, примерно с частотой 10-6

Рисунок 4.7. Строение репликативной вилки
У эукариот ферменты работают точнее, так как они более сложно устроены, уровень ошибок при репликации ДНК у человека оценивается как 10-7–10-8. Точность репликации может быть разной на разных участках генома, есть участки с повышенной частотой мутаций и есть участки более консервативные, где мутации происходят редко.
По мере продвижения репликационной вилки SSB-протеины передвигаются по цепи, диссоциируя с одного места и присоединяясь на другом. Этот процесс не требует затрат энергии АТФ. После освобождения достаточного места начинается синтез праймера - затравки, необходимой для работы ДНК-полимеразы. В качестве затравки на каждой из разделенных цепей синтезируются маленькие отрезки молекул РНК при помощи фермента примазы (рис. 4.8.).
ДНК-полимераза способна наращивать ДНК только на 3΄- конце. При синтезе новых копий на каждой нити одна новая нить удлиняется в направлении от 5΄ к 3΄, а другая – в направлении от 3΄ к 5-концу. Однако 5΄ конец ДНК-полимераза наращивать не может. Поэтому синтез одной нити ДНК, той, которая растет в "удобном" для фермента направлении, идет непрерывно (она называется лидирующая или ведущая нить), а синтез другой нити осуществляется короткими фрагментами (они называются фрагментами Оказаки). Когда синтез на одном из фрагментов Оказаки достигает праймера другого фрагмента, РНК-овый праймер удаляется имеющейся у полимераз 5'-3' экзонуклеазной активностью и достраивается дезоксирибонуклеотидами (рис. 4.9.). После этого сахарофосфатный остов между фрагментами сшивается ковалентной связью при помощи фермента ДНК-лигазы.
|
|
|

Рисунок 4.8. Белки, участвующие в репликации ДНК

Рисунок 4.9. Белки, участвующие в репликации ДНК
Частота возникновения ошибок при репликации и транскрипциине превышает 10-8-10-9, то есть возможна лишь одна ошибка на сотни миллионов нуклеотидов. Такая точность не может быть обеспечена одним только лишь правилом комплементарности нуклеотидов (обеспечивающим точность 1:10000-1:100000). Репликационный аппарат имеет собственные механизмы "поддержания точности" копирования генетической информации. Этими функциями обладают все ДНК-полимеразы. Модель структуры и функциональных участков (на примере ДНК-полимеразы I) показана на рисунке 4.9. Она имеет три зоны активности - полимеризующую в направлении 5'-3', и экозонуклеазные в направлениях 5'-3' и 3'-5'. Области активности разделены пространственно. Вперед (по ходу продвижения полимеразы по матричной цепи ДНК) обращена зона 5'-3' экзонуклеазной активности. Она служит для удаления попадающихся на пути РНК-овых праймеров. Далее идет собственно синтетическая зона и наконец, зона с экзонуклеазной активностью в направлении 3'-5'. С этой зоной связана способность узнавать неправильно встроенные нуклеотиды и исправлять их вырезанием ряда уже встроенных нуклеотидов. Для этого молекула ДНК-полимеразы смещается (не отсоединяясь от ДНК-овой матрицы) к месту синтеза и последовательно вырезает нуклеотиды, после чего возобновляется нормальный синтез.
Молекулы РНК очень часто претерпевают посттранскрипционную модификацию, заключающуюся в удалении участков построенной цепи. Процессинг (созревание) мРНК. Синтезированная молекула мРНК (первичный транскрипт) подвергается дополнительным превращениям. В большинстве случаев исходная молекула мРНК разрезается на отдельные фрагменты. Одни фрагменты – интроны – расщепляются до нуклеотидов, а другие – экзоны – сшиваются в зрелую мРНК. Процесс соединения экзонов называется сплайсингом. Наглядно это можно проследить на примере синтеза молекулы транспортной РНК (рис. 4.10).
Сплайсинг характерен для эукариот и архебактерий, но иногда встречается и у прокариот. Существует несколько видов сплайсинга. Сущность альтернативного сплайсинга заключается в том, что одни и те же участки исходной мРНК могут быть и интронами, и экзонами. Тогда одному и тому же участку ДНК соответствует несколько типов зрелой мРНК и, соответственно, несколько разных форм одного и того же белка. Установлено, что некоторые генетические заболевания человека (фенилкетонурия, некоторые гемоглобинопатии) обусловлены нарушением сплайсинга.
|
|
|
Сущность транс–сплайсинга заключается в соединение экзонов, кодируемых разными генами (иногда даже из разных хромосом), в одну зрелую молекулу мРНК.
Регуляция на уровне процессинга РНК обеспечивает возможность образования различных типов зрелой, функционально активной мРНК. Процессинг РНК регулируется с помощью рибозимов (катализаторов рибонуклеиновой природы) и ферментов матураз.

Транскрипция
Транскрипция – синтез РНК на ДНК, то есть синтез комплементарной нити РНК на молекуле ДНК осуществляется ферментом РНК-полимеразой. У бактерий, например, кишечной палочки – одна РНК-полимераза, и все бактериальные ферменты очень похожи друг на друга; у эукариот – несколько ферментов, они называются РНК-полимераза I, РНК-полимераза II, РНК-полимераза III, они имеют сходство с бактериальными ферментами, но устроены сложнее. Каждый вид эукариотической РНК-полимеразы обладает своими специальными функциями, то есть транскрибирует определенный набор генов. Нить ДНК, которая служит матрицей для синтеза РНК при транскрипции, называется смысловой или матричной. Вторая нить ДНК называется некодирующей (комплементарная ей РНК не кодирует белки, она "бессмысленная").
Транскрипция происходит не на всей молекуле ДНК (хромосоме), а лишь на одном участке, отвечающем определенному гену. Транскрипция может происходить одновременно на нескольких участках молекулы ДНК, в разных молекулах. Начало и конец синтеза всех типов РНК на матрице ДНК строго фиксированы специальными триплетами.
В процессе транскрипции можно выделить три этапа. Первый этап - инициация транскрипции – начало синтеза нити РНК, образуется первая связь между нуклеотидами. Затем идет наращивание нити, ее удлинение – элонгация, и, когда синтез завершен, происходит терминация, освобождение синтезированной РНК. РНК-полимераза при этом "слезает" с ДНК и готова к новому циклу транскрипции.
Бактериальная РНК-полимераза изучена очень подробно. Она состоит из нескольких белковых субъединиц: двух α-субъединиц, β- и β΄-субъединиц и ω-субъединицы. Вместе они образуют так называемый минимальный фермент, или кор-фермент. К этому кор-ферменту может присоединяться σ-субъединица. σ-субъединица необходима для начала синтеза РНК, для инициации транскрипции. После того, как инициация осуществилась, σ-субъединица отсоединяется от комплекса, и дальнейшую элонгацию цепи ведет кор-фермент. При присоединении к ДНК σ-субъединица распознает участок, на котором должна начинаться транскрипция. Он называется промотор. Промотор - это последовательность нуклеотидов, указывающих на начало синтеза РНК. Без σ-субъединицы кор-фермент промотор распознать не может. σ-субъединица вместе с кор-ферментом называется полным ферментом, или холоферментом.
Связавшись с ДНК, а именно с промотором, который распознала σ-субъединица, холофермент расплетает двунитевую спираль и начинает синтез РНК. Участок расплетенной ДНК – это точка инициации транскрипции, первый нуклеотид, к которому должен комплементарно быть присоединен рибонуклеотид.
Инициируется транскрипция, σ-субъединица уходит, а кор-фермент продолжает элонгацию цепи РНК. Затем происходит терминация, кор-фермент освобождается и становится готов к новому циклу синтеза (рис. 4.11.). Как происходит элонгация транскрипции?

Рисунок 4.11. Общая схема транскрипционного цикла
РНК наращивается на 3΄-конце. Присоединением каждого нуклеотида кор-фермент делает шаг по ДНК и сдвигается на один нуклеотид. Так как все в мире относительно, то можно сказать, что кор-фермент неподвижен, а сквозь него "протаскивается" ДНК. Размер белкового комплекса, составляющего кор-фермент, 150 А. Размеры РНК-полимеразы - 150×115×110 А. То есть это такая наномашина. Скорость работы РНК-полимеразы – до 50 нуклеотидов в секунду. Комплекс кор-фермента с ДНК и РНК называется элонгационным комплексом Рис. 4.12.). В нем находится ДНК-РНК гибрид. То есть это участок, на котором ДНК спарена с РНК, и 3΄-конец РНК открыт для дальнейшего роста. Размер этого гибрида – 9 пар оснований. Расплетенный участок ДНК занимает примерно 12 пар оснований.
РНК-полимераза связанна с ДНК перед расплетенным участком. Этот участок называется передним дуплексом ДНК, его размер – 10 пар оснований. Полимераза связана также с более длинной частью ДНК, называемой задним дуплексом ДНК. Размер матричных РНК, которые синтезируют РНК-полимеразы у бактерий, могут достигать 1000 нуклеотидов и больше. В эукариотических клетках размер синтезируемых РНК может достигать 100000 и даже нескольких миллионов нуклеотидов.
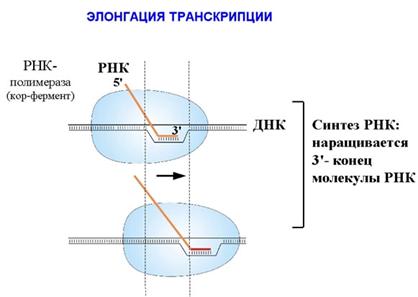
Рисунок 4.12. Элонгация транскрипции
Элонгационный комплекс довольно стабилен, т.к. он должен выполнить большую работу (рис. 4.13). То есть, сам по себе он с ДНК не "свалится". Он способен перемещаться по ДНК со скоростью до 50 нуклеотидов в секунду. Взаимодействие ДНК с РНК-полимеразой (кор-ферментом) не зависит от последовательности этой ДНК, в отличие от σ-субъединицы. И кор-фермент при прохождении определенных сигналов терминации завершает синтез ДНК.

Рисунок 4.13. Строение элонгационного комплекса
Рассмотрим более подробно молекулярную структуру кор-фермента. Кор-фермент состоит из α- и β-субъединиц. Они соединены так, что образуют как бы "пасть" или "клешню". α-субъединицы находятся в основании этой "клешни", и выполняют структурную функцию. С ДНК и РНК они, по-видимому, не взаимодействуют. ω-субъединица – небольшой белок, который также выполняет структурную функцию. Основная часть работы приходится на долю β- и β΄-субъединиц. На рисунке β΄-субъединица показана наверху, а β-субъединица – внизу (рис. 4.14; 4.15.).
Внутри "пасти", которая называется главным каналом, находится активный центр фермента. Именно здесь происходит соединение нуклеотидов, образование новой связи при синтезе РНК. Главный канал в РНК-полимеразе – это то место, где во время элонгации находится ДНК. Еще в этой структуре сбоку есть так называемый вторичный канал, по которому подаются нуклеотиды для синтеза РНК.
Распределение зарядов на поверхности РНК-полимеразы обеспечивает ее функции. Молекула нуклеиновой кислоты заряжена отрицательно. Поэтому полость главного канала, где должна удерживаться отрицательно заряженная ДНК, выложена положительными зарядами. Поверхность РНК-полимеразы выполнена отрицательно заряженными аминокислотами, чтобы ДНК к ней не прилипала.
РНК-полимераза работает как молекулярная машина, и в ней есть различные детали, каждая из которых выполняет свою функцию. Например, нависающая над "пастью" часть β΄- субъединицы удерживает передний ДНК-дуплекс. Эта часть называется "заслонкой". После связывания с ДНК заслонка опускается, проходя путь в 30 А, и зажимает ДНК так, чтобы она не могла выпасть в процессе транскрипции.
Внутри "пасти" находится активный центр РНК-полимеразы, то есть то место, где непосредственно происходит комплементарное взаимодействие поступившего по боковому каналу рибонуклеоиздтрифосфата с ДНК-матрицей.
Если вновь прибывший нуклеотид комплементарен матрице, то он ферментативно пришивается к свободному 3' –концу РНК. По характеру реакция образования новой связи в РНК относится к реакциям нуклеофильного замещения. В ней участвуют два иона магния. Один ион постоянно находится в активном центре, а второй ион магния поступает с нуклеотидом и после образования новой связи между рибонуклеотидами уходит, затем поступает новый нуклеотид со своим новым ионом магния.
При выходе из РНК-полимеразы ДНК-РНК гибрид должен быть расплетен. В этом участвует структура, называемая "шип".
В транслокации, то есть перемещении РНК-полимеразы по нити ДНК, участвует α-спиральная структура, снизу вверх торчащая из β-субъединицы.
Известно, что магний координирует связь между фосфатами растущей молекулы ДНК и фосфатами вновь входящих нуклеотидов. При этом происходит последовательность реакций, называемых реакциями нуклеофильного замещения. Известно, каким образом меняются связи внутри этого комплекса. Новый нуклеотид приходит, будучи связанным с еще одним ионом магния. Новый нуклеотид, таким образом, взаимодействует с растущей цепью ДНК. В конце реакции, второй ион магния выводится из активного центра фермента.

Рисунок 4.14. Структура РНК-полимеразы


Рисунок 4.15. Структурные элементы РНК-полимеразы
РНК-полимераза является представителем молекулярных машин. Помимо того, что в начале синтеза ДНК опускается заслонка, меняется конформация других частей РНК-синтазы, в ней во время роста цепи РНК происходят циклические изменения, не такие сильные, как при начале синтеза цепи. В начале заслонка опускается на 30 Ǻ, а при каждом шаге фермента ДНК протягивается на один нуклеотид. В перемещении по ДНК участвует элемент РНК-полимеразы F-спираль. F-спираль при этом изгибается, перемещается вместе с комплексом РНК-ДНК, освобождается от них и опять выпрямляется. Перемещается F-спираль за один шаг на 3,4 Ǻ. Именно такой шаг у РНК-полимеразы.
Изменение конформации различных частей РНК-полимеразы происходит за счет изменения потенциальной энергии, что связано с электростатическими и гидрофобными взаимодействиями. Источником движения молекулярной машины является энергия теплового движения отдельных ее составляющих, а устройство машины таково, что это движение приводит к нужному результату. При этом молекулярная машина потребляет энергию, которая, в основном, идет на изменение состояния тех или иных связей.
Инициация транскрипции осуществляется с участием σ-субъединицей (рис. 4.16). Она взаимодействует с промотором. За десять нуклеотидов до точки инициации находится ТАТА-бокс (у кишечной палочки). Такая последовательность является "идеальной" для взаимодействия с σ-субъединицей, то есть такой, с которой транскрипция инициируется наиболее эффективно. Замена отдельных нуклеотидов в этой последовательности снижает эффективность инициации транскрипции. Еще примерно за 35 нуклеотидов до него находится структура, называемая "-35". Эту последовательность также распознает σ-субъединица. Эту структуру (сочетание последовательностей "–10" и "–35") назвали классическим промотором, т.к. она была описана первой.

Рисунок 4.16. Общая схема инициации транскрипции
Но оказалось, что устройство промотора может быть и другим. Этот вариант включает в себя тот же ТАТА-бокс, но нет последовательности "-35", однако есть дополнительно два нуклеотида, и этого достаточно, чтобы σ-субъединица распознала промотор. Эта структура называется расширенным промотором. σ-субъединица РНК-полимеразы садится на промотор в ДНК и разными частями белковой молекулы взаимодействует с частями промотора.
Распознает его σ-субъединица через большую бороздку ДНК. После того, как σ-субъединица в составе кор-фермента связалась с промотором, ДНК на этом участке начинает плавиться (расплетаются нити ДНК). Промотор содержит пары А-Т, поэтому плавится он достаточно легко. И затем начинается синтез РНК, растущая цепь РНК выталкивает σ-субъединицу и происходят еще другие изменения, которые вызывают диссоциацию σ-субъединицы от кор-фермента.
Еще одной особенностью транскрипции является то, что кор-фермент бактериальной клетки один и тот же, а σ-субъединицы могут быть разными. У кишечной палочки всего 7 σ-субъединиц, они узнают разные промоторы.
Зачем это нужно? Если клетке срочно нужно переключить синтез белков с одной группы генов на другую, она может использовать разные σ-субъединицы. Например, есть гены теплового шока, если кишечную палочку подогреть до состояния, когда жить ей станет очень тяжело, она включает аварийную систему сопротивления тепловому шоку, сопротивления тем разрушениям, которые произошли в клетке. В эту систему входит тот набор генов, который в норме работать не должен, перед этими генами свой особый промотор. И тогда другая σ-субъединица, не основная, синтезируется и активирует эти гены. То есть смена субъединицы – это смена программы работы генов. Это способ регуляции работы генов.
Трансляция белков
Трансляция или синтез белков происходит на рибосомах. Рибосома состоит из двух субчастиц: большой и малой. Основу каждой субъединицы рибосомы составляют специфически сложенные молекулы рРНК. К каркасу из рРНК присоединяются рибосомные белки.
Еще один вид РНК, участвующей в синтезе белка, это транспортная РНК (тРНК). Молекулы тРНК относительно небольшие (по сравнению с рибосомной или матричной РНК).
Все тРНК имеют общую вторичную структуру (рис. 4.17). За счет спаривания комплементарных участков молекулы тРНК образуется три "стебля" с петлями на концах и один "стебель", образованный 5'- и 3'-концами молекулы тРНК (иногда образуется еще дополнительная пятая петля).
Изображение этой структуры похоже на крест или клеверный лист. "Голова" на этом листе представлена антикодонной петлей, здесь находится антикодон – те три нуклеотида, которые комплементарно взаимодействуют с кодоном в мРНК. Противоположный антикодонной петле стебель, образованный концами молекулы, называется акцепторным стеблем – сюда присоединяется соответствующая аминокислота.
Распознают подходящие друг другу тРНК и аминокислоты специальные ферменты, называемые аминоацил-тРНК синтетазами. Для каждой аминокислоты есть своя аминоацил-тРНК синтетаза. В молекуле аминоацил-тРНК синтетазы имеется три различных субстрат-связывающих центра – два высоко специфичны в отношении тРНК и аминокислоты, третий – неспецифичный центр для АТФ.

Рисунок 4.17. Структура молекулы тРНК
Образовавшиеся аминоацил-тРНК переносятся к рибосомам, на которых осуществляется процесс полимеризации аминокислот с образованием пептидных связей.
Рибосома состоит из двух субчастиц: большой и малой (рис. 4.18). Основу каждой субъединицы рибосомы составляют специфически сложенные молекулы рРНК. К каркасу из рРНК присоединяются рибосомные белки.
Каждая рибосомная субчастица содержит одну молекулу высокополимерной рибосомной РНК, составляющую от половины до двух третей всей массы субчастицы. Соответственно большая субчастица содержит в два раза более длинную рибосомную РНК, чем малая субчастица рибосомы.
У бактерий это 23S РНК (около 3000 нуклеотидов) и 16S РНК (около 1500 нуклеотидов), а у животных 28S РНК (4700-4800 нуклеотидов) и 18S РНК (около 1900 нуклеотидов).

Рисунок 4.18. Пространственная организация рибосом
Помимо высокополимерной РНК большая рибосомная субчастица содержит одну или две молекулы относительно низкомолекулярных РНК - это 5S РНК в случае бактерий и других прокариот или 5S РНК и 5,8S РНК в случае эукариотических организмов. Указанные малые рибосомные РНК сопоставимы по размерам с рибосомными белками и вместе с ними располагаются на ядре высокополимерной рибосомной РНК как на каркасе.
Каждая субчастица состоит из нескольких десятков белков, каждый из которых специфическим образом уложен в субчастицу (рис. 4.19). Белки в рибосоме держатся на каркасе, состоящем из рибосомной РНК.
Формирование рибосомы начинается с того, что рибосомная РНК сворачивается и на нее в определенном порядке начинают налипать белки. В рибосомной РНК самокомплементарные участки нити РНК спариваются, образуя шпильки (вторичная структура), и затем РНК сворачивается (третичная структура РНК), образуя каркас субчастиц.
Константа седиментации (скорость оседания в ультрацентрифуге) рибосом эукариотических клеток равняется 80S (большая и малая субъединицы 60S и 40S, соответственно), бактериальных клеток (а так же митохондрий и пластид) - 70S (большая и малая субъединицы 50S и 30S, соответственно).
Рибосомы впервые были описаны как уплотненные частицы, или гранулы, биологом румынского происхождения Джорджем Паладе в середине 1950-х годов. В 1974 г. Паладе, Клод и Кристиан Де Дюв получили Нобелевскую премию по физиологии и медицине "за открытия, касающиеся структурной и функциональной организации клетки". Термин "рибосома" был предложен Ричардом Робертсом в 1958 вместо "рибонуклеобелковая частица микросомальной фракции".
На схеме (рис. 4.19) представлены основные этапы образования рибосом. 1. Синтез мРНК рибосомных белков РНК полимеразой II. 2. Экспорт мРНК из ядра. 3. Узнавание мРНК рибосомой и 4. синтез рибосомных белков. 5. Синтез предшественника рРНК (45S - предшественник) РНК полимеразой I. 6. Синтез 5S pРНК РНК полимеразой III. 7. Сборка большой рибонуклеопротеидной частицы, включающей 45S-предшественник, импортированные из цитоплазмы рибосомные белки, а также специальные ядрышковые белки и РНК, принимающие участие в созревании рибосомных субчастиц. 8. Присоединение 5S рРНК, нарезание предшественника и отделение малой рибосомной субчастицы. 9. Дозревание большой субчастицы, высвобождение ядрышковых белков и РНК. 10. Выход рибосомных субчастиц из ядра. 11. Вовлечение их в трансляцию.
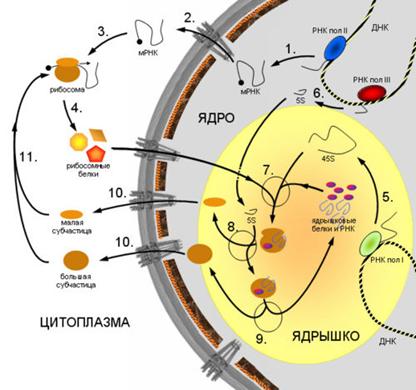
Рисунок 4.19. Схема образования рибосом
Трансляция - синтез белка рибосомой на основе информации, записанной в мРНК. мРНК связывается с малой субъединицей рибосомы, когда происходит узнавание 3'-концом 16S рибосомной РНК комплементарной последовательности Шайн-Далгарно, расположенной на 5'-конце мРНК (у прокариот), а также позиционирование стартового кодона (как правило, AUG) мРНК на малой субъединице. Ассоциация малой и большой субъединиц происходит при связывании формилметионил-тРНК (fMET-тРНК) и участии факторов инициации (IF1, IF2 и IF3 у прокариот; их аналоги и дополнительные факторы участвуют в инициации трансляции у эукариотических рибосом). Таким образом, распознавание антикодона (в тРНК) происходит на малой субъединице
В рибосоме находится матричная РНК (мРНК). С кодоном мРНК комплементарно связан антикодон транспортной РНК, на которой висит остаток аминокислоты. На рисунке 4.20. видна такая структура.

Рисунок 4.20. Общая схема процесса трансляции
Трансляцию мРНК в полипептидную последовательность можно разделить на три этапа: инициация белковой цепи, элонгация и терминация.
Синтез белка на рибосоме начинается с инициирующего кодона метионина - AUG (реже GUG). Инициирующая тРНК метионина акцептирует остаток метионина, который затем трансформилируется. Образовавшаяся N-формилметионин-тРНК участвует в инициации полипептидной цепи. Так как аминогруппа инициирующего метионина заблокирована, наращивание полипептидной цепи может осуществляться только с С-конца.
Процесс инициации начинается с образования инициирующего комплекса, в который входит 30S-субъединица, мРНК, формил-метионил-тРНК и три специфических фактора инициации. Далее инициирующий комплекс взаимодействует с 50S-субъединицей и образуется функционально активная 70S-рибосома. Этот процесс сопровождается распадом ГТФ и высвобождением всех трех факторов инициации, ГДФ и неорганического фосфата.
В образовавшемся рибосомном функциональном комплексе имеется два участка связывания тРНКмет. Один из них – А-участок – аминоацильный, а другой – Р-участок (пептидильный), в котором располагается метионил-тРНКф. При этом мРНК своим метиониновым кодоном связана с антикодоном.
Процесс трансляции, также как и процесс транскрипции, связан с перемещением вдоль молекулы нуклеиновой кислоты, разница в том, что рибосома шагает на три нуклеотида, в то время как РНК-полимераза - на один. Процесс элонгации начинается с кодон-зависимого связывания аминоацил-тРНК с А-участком.
После ассоциации, fMET-тРНК оказывается в P (peptidyl-) центре рибосомы. Следующая тРНК, несущая на 3'-конце аминокислоту, и комплементарная второму кодону на мРНК, связывается с помощью фактора EF-Tu на А (аминоацил-) центре рибосомы. Затем, на большой субъединице, в пептидил-трансферазном центре рибосомы, образуется пептидная связь между формилметионином (связанным с тРНК, находящейся в Р-центре) и аминокислотой, находящейся в А-центре.
На этапе, названном этапом транспептидации, аминогруппа вновь пришедшей аминоацил-тРНК взаимодействует с этерифицированной карбоксильной группой формилметионин-тРНКмет. В результате образуется пептидная связь между аминоацил-тРНК и остатком формилметионина, который переносится с пептидильного участка в аминоацильный. На этом этапе происходит вытеснение использованной тРНК с Р-участка в раствор и перемещение мРНК, в результате которого очередной кодон устанавливается в А-участке. Реакция катализируется пептидилтрансферазой.
Рибосомы осуществляют трансляцию до тех пор, пока не достигнут терминирующих кодонов – UAA, UAG, UGA. Эти кодоны не имеют своей аминоацил-тРНК и на них трансляция прекращается.
Терминирующие кодоны узнаются факторами терминации, которыевзаимодействуют с рибосомой и индуцируют гидролиз сложноэфирной связи между тРНК и полипептидом молекулы пептидил-тРНК в пептидильном участке. В результате полипептидная цепь высвобождается из рибосомы.
Синтез белковых молекул идет непрерывно и с большой скоростью. Синтез одной молекулы белка длится 3-4 сек. В одну минуту образуется от 50 до 60 тысяч пептидных связей. Половина белков нашего тела обновляется за 80 дней. За всю свою жизнь человек обновляет свой белок около 200 раз.
Отражение структуры белков в виде триплетов ДНК называется кодом ДНК. Благодаря генетическому коду устанавливается однозначное соответствие между нуклеотидными последовательностями нуклеиновых кислот и аминокислотами, входящими в состав белков. "Словарь" для перевода с языка нуклеотидов на язык аминокислот называется генетическим кодом (табл. 4.2.). Аминокислот - 20, нуклеотидов – 4, число комбинаций из 4 по 2 = 16, а аминокислот 20, поэтому кодировка не двух, а трехбуквенная, каждая тройка называется кодоном. Каждая аминокислота кодируется тремя нуклеотидами в мРНК (которая, в свою очередь, кодируется ДНК).
В таблице на рисунке боковые столбцы кодируют левую и правую букву кодона, верхняя строка – среднюю. Например, кодон AUG кодирует аминокислоту метионин. Число комбинаций из 4 по 3 = 64, то есть некоторые аминокислоты кодируются несколькими кодонами. Три кодона не кодируют никакую аминокислоту, они называются терминирующими.
Таблица генетического кода была составлена в 60-х годах. Начало положили Ниренберг и Маттеию. Они пытались производить в пробирке эксперименты на клеточных экстрактах, к которым были добавлены искусственные матрицы РНК. В то время считалось, что кодоны, состоящие из одного нуклеотида (UUU или ААА) не кодируют аминокислоты.
Ниренберг и Маттеи использовали полиU-РНК (то есть состоящую только из урацилов) в качестве контроля в своих опытах, но именно в этой пробирке прошла реакция. Стало ясно, что кодон UUU кодирует аминокислоту фенилаланин. Затем была составлена таблица генетического кода.
Таблица 4.2.
Генетический код

Генетический код обладает следующими основными свойствами:
1. Генетический код триплетен: каждая аминокислота кодируется триплетом нуклеотидов ДНК и соответствующим триплетом иРНК. При этом кодоны ничем не отделены друг от друга.
2. Генетический код является избыточным (вырожденным): почти все аминокислоты могут кодироваться разными кодонами. Только двум аминокислотам соответствует по одному кодону: метионину (АУГ) и триптофану (УГГ). Зато лейцину, серину и аргинину соответствует по 6 разных кодонов.
3. Генетический код является неперекрывающимся: каждая пара нуклеотидов принадлежит только одному кодону (исключения обнаружены у вирусов).
4. Генетический код един для подавляющего большинства биологических систем. Однако имеются и исключения, например, у инфузорий и в митохондриях разных организмов. Поэтому генетический код называют квазиуниверсальным.
|
|
|


