 |
Будущее генной терапии. Медленный старт, но большие надежды.
|
|
|
|
Основная масса исследований на сегодняшний день проводится в США (рис. 22.12 – 22.15). Около 66 % проектов находятся на фазе первых I клинических испытаний (оценка токсичности генной конструкции); около 20 % - между фазами I и II (ограниченные испытания на небольшом контингенте больных); около 12% - на фазе II и около 2 % относятся к фазам II/III и III (широкомасштабные клинические испытания в нескольких центрах, в основном касающиеся генной терапии опухолей).
Более 60 % проводимых клинических испытаний по генотерапии посвящено лечению опухолей. При котором используют целый набор различных экспрессирующихся генно-инженерных конструкций, продукты которых воздействуют на разные факторы и механизмы прогрессии опухоли.
Значительное число центров (12 %) проводят клинические испытания по лечению моногенных заболеваний. В 1999 г. в США больной с конечностно-плечевой формой мышечной дистрофии (LGMD (мутация в гене мышечного белка саркогликана)) стал первым пациентом с нервно-мышечным заболеванием, который получил инъекцию генно-инженерной конструкции на базе аденоассоциированного вируса с кДНК гена саркогликана.
Лечению сердечно-сосудистой патологии посвящено 8 % проектов клинических испытаний. Два проекта из них находятся на третьей, завершающей стадии. Это индукция терапевтического ангиогенеза в ишемическом миокарде путем имплантации в миокард конструкции с геном эндотелиального фактора роста сосудов (VEGF-A165) или гена фактора роста (FGF4).
Генотерапевтические методы нашли применение и при создании нового поколения вакцин (генной вакцинации) против многих инфекционных болезней, включая вирусные инфекции, и даже опухолей. Около 6 % протоколов клинических испытаний посвящены лечению и профилактике инфекционных болезней – СПИДа, гепатита В, туберкулеза и др.
|
|
|

Рис. 22.12. Распределение по континентам пациентов, принимающих участие в программе генная терапия.
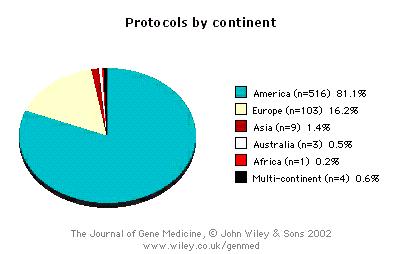
Рис. 22.13. Распределение по континентам протоколов клинических испытаний генной терапии.

Рис. 22.14. Распределение по странам пациентов, принимающих участие в программе генная терапия.

Рис.22.15. Распределение по странам протоков клинических испытаний генной терапии.
В России по данным В.С. Баранова (член-корреспондент РАМН, профессор, заведующий лабораторией пренатальной диагностики наследственных и врожденных болезней НИИ акушерства и гинекологии им. Д.О. Отта РАМН, главный специалист по медицинской генетике г. Санкт-Петербурга) позиция генной терапии плачевная. Ни один из 600 международных проектов по ГТ не выполняется в России. На Ежегодной Европейской конференции присутствовало только 4 представителя России. На фоне общего недофинансирования науки, число лабораторий, занимающихся в нашей стране вопросами ГТ, можно легко пересчитать по пальцам. Попытки разработать ДНК-вакцины предпринимаются в Новосибирске (Институт биоорганической химии РАН), начаты клинические испытания по генной терапии некоторых опухолей в Москве и Санкт-Петербурге (НИИ молекулярной генетики РАН, НИИ онкологии МЗ РФ) и некоторых нервно-мышечных заболеваний (НИИ акушерства и гинекологии им. Д.О. Отта РАМН). Между тем, мировой опыт показывает, что лишь при наличии передового уровня технологий в генетике, молекулярной биологии, биохимии, цитологии и медицине можно рассчитывать на серьезные результаты и в области ГТ.
Перспективными на сегодняшний день остаются вирусные векторы, особенно, на основе аденоассоциированных вирусов. Учитывая настороженное отношение ко всем вирусным векторам, значительное оживление отмечается в области работ по невирусным носителям генов. Огромный прогресс достигнут в области фундаментальных исследований малых интерферирующих РНК (siRNA). В частности, их использования для направленной регуляции транскрипции и трансляции определенных генов. С помощью малых ядерных РНК, обладающих ферментативной активностью – рибозимов широко проводятся исследования по направленной регуляции функции генов, выключению вирусов, созданию библиотек рибозимов для каждого из 30 000 генов человека. Очень перспективными для ГТ представляются исследования по трансфекции стволовых клеток. Такие генетически модифицированные стволовые клетки могут явиться предпосылкой начала качественно нового этапа в генной терапии моногенных и онкологических заболеваний.
|
|
|
Среди реальных практических достижений ГТ, помимо более 600 уже одобренных проектов клинических испытаний, наиболее близки к широкому практическому применению иммунодефицитные состояния, некоторые онкологические заболевания, диабет, заболевания сосудов, трофические язвы.
Проектные задания
Подготовьте реферат на тему:
1. 1. Гены и генная терапия.
2. Генная терапия – новая эра новой эры.
3. Развитие генной терапии в России.
4. Реальности и надежды современной генотерапии.
5. Генная терапия: спектр возможных для лечения болезней.
6. Моральные проблемы генной терапии.
7. Генотерапия: перспективы применения для разных болезней.
8. Фетальная генотерапия.
9. Соматическая генотерапия.
10. Генотерапия моногенных наследственных заболеваний.
11. Генотерапия заболеваний сердечно-сосудистой системы.
12. Лечение и профилактика инфекционных заболеваний методами генной терапии.
13. Генотерапия опухолей.
14. Допинги и генная терапия.
15. Генная терапия в офтальмологии.
16. Генная терапия сахарного диабета.
17. Перспективы генной терапии в утробе матери.
18. Современные методы доставки генных конструкций.
19. Генная терапия недостаточности аденозиндезаминазы.
20. Тирозинэмия наследственная первого типа (НТ1): генная терапия.
21. Гиперхолестеролэмия наследственная: перспективы применения генной терапии.
22. Фенилкетонурия: перспективы применения генной терапии.
23. Гемофилия А и В: перспективы генной терапии.
|
|
|
24. Муковисцидоз: перспективы генной терапии.
25. Неврологические наследственные заболевания: перспективы генной терапии
26. Мышечная дистрофия Дюшена: генная терапия
Литература
1. Альбертс Б. Молекулярная биология клетки. - М: Мир, 1987 Т.2 - 563с.
2. Баранов В.С. Генная терапия - медицина XXI века // Соросовский образовательный журнал, 1999. - №3. - С. 63.
3. Власова И.Е., Нечаева М.В., Власов В.В. Системы доставки нуклеиновых кислот в клетки млекопитающих // Успехи совр. Биол. – 1994. – Т.114, № 6. – С.715-727.
4. Гинтер Е.К. Генотерапия наследственных болезней // Вопросы медицинской химии, 2000. - № 3.
5. Глик Б., Пастернак Дж. Молекулярная биотехнология. Принципы и применение. Пер. с англ. –М.: Мир, 2002. -589с.
6. Горбунова В.Н., Баранов В.С. Введение в молекулярную диагностику и генотерапию наследственных заболеваний. – СПб.: "Специальная Литература", 1997.-287с.
7. Жданов Р.И., Семенова Н.В., Арчаков А.И. Реальности и надежды современной генотерапии. // Вопросы медицинской химии. 2000г.
8. Жимулев И.Ф. Общая и молекулярная генетика. Изд-во Новосибирского университета. 2002.
9. Зеленин А.В. Генная терапия на границе третьего тысячелетия // вестник российской академии наук. -2001. Т.71, №5. –с.387-395.
10. Дризе Н.И. Генотерапия. Возможности ее применения // Гематол. Трансфузиол. – 1994. –Т.39, №4. – С.39-41.
11. Иллариошкин С.Н. ДНК-диагностика и медико-генетическое консультирование. –М.: Медицинское информационное агентство, 2004. – 207с.
12. Кисилев А.В., Баранов А.Н., Баранов В.С. Генная терапия: Состояние проблемы и перспективы // В сб. Молекулярно-биологические технологии в медицинской практике. Новосибирск. 2003. –С. 49-74.
13. Молекулярная клиническая диагностика. Методы: пер. с англ./ Под ред. С. Херрингтона, Дж. Макги. – М.: Мир, 1999. – 558с.
14. Сингер М., Берг П. Гены и геномы. В 2-х томах: пер. с англ. М.: Мир, -764 с.
15. Фогель Ф. Мотульски А. Генетика человека. М.: Мир. 1989. Т.1. 312с.
16. Alton E.W.F.W., Hay J.G., Munro С. (1987) Thorax., 42, 815-817.
17. Bellon G., Calmard L., Thouvenot D., et al. (1996) C.R. Seances Soc. Biol. Fil., 190, 109-142.
18. Bilbao et al. Targeted adenoviral vectors for cancer gene therapy // Adv. Exp. Med. Biol. – 1998. – V. 451. – P.365-374.
19. Caplen N.J., Alton E., Middleton P.G, et al. (1995) Nature Med., 1, 39-46
|
|
|
20. Crystal R.G. et al. (1994) Nat. Genet., 8, 42-51
21. Dorin J.R., Parley R., Webb S., et al. (1996) Gene Ther., 9, 797-801.
22. Dutheil et al. Adeno-associated virus site-specifically integrates into a muscle-specific DNA region // PNAS. – 2000. – V. 97. – P. 4862-4866.
23. Fallaux et al. New helper cells and matched early region 1-deleted adenovirus vectors prevent generation of replication-competent adenoviruses // Hum. Gene Ther. – 1998. – V. 9/ - P.1909-1917.
24. Gregory R.J., Cheng S.H., Rich D.P. et al. (1990) Nature, 347, 382-386.
25. Grosveld F., Blom van Assendelft G., Greaves D.R., et al. (1987) Cell, 51, 975-985.
26. Grubb B.R., Boucher R.C. (1999) Physiol. Rev., 79 (Suppl.), S I 93-214
27. Hartikka et al. Electroporation-facilitated delivery of plasmid DNA in skeletal muscle: plasmid dependence of muscle damage and effect of poloxamer 188 // Mol. Ther. – 2001. – V. 4. – P. 407-415.
28. Hauswirth W.W., Mclnnes R.R. (1998) Mol. Vis., 21, 4- 11.
29. Herweijer, Wolff Progress and prospects: naked DNA gene transfer and therapy // Gene Ther. – 2003. -V. 10.- P. 453-458.
30. Higgs D.R., Wood W.G., Jarman A.P., et al. (1990) Genes Dev., 4, 1588- 1601.
31. Jaenisch R. (1988) Science, 240, 1468 – 1474.
32. Johnson L.G, Olsen J.C., Sarkadi B. et al. (1992) Nat. Genet., 2, 21-25.
33. Kaplitt M.G., Feigin A., Tang C. et al. Safety and tolerability of gene therapy with an adeno-associated virus (AAV) borne GAD gene for Parkinson's disease: an open label, phase I trial // Lancet. - 2007. - V.369(9579). - P.2097-105.
34. Knowles M.R., Hohneker K.W., Zhou Z., et al (1995) New. Engl. J. Med., 333, 823-831.
35. Knowles M.R., Noone P.G., Hohneker K., et al. (1998) Hum Gene Ther., 9, 249-269.
36. Kochanek et al. High-capacity “gutless” adenoviral vectors // COMT/ - 2001. – V. 3. – P. 454-463.
37. Lalwani A.K, Walsh B.J., Reilly P.G., et al. (1996) Gene Ther., 3, 588-592.
38. Lien Y.H.,LaiL.W. (1997) Kidney Int.,61. (Suppl.), S85-88.
39. Lucas et al. IL-12 plasmid delivery by in vivo electroporation for the successful treatment of established subcutaneous B16.F10 melanoma // Mol. Ther. 2002. – V. 5. – P. 668-675.
40. Martin-Rendon et al. Lentiviral vectors for treatment of neurodegenerative diseases // COMT. – 2001. – V.3. – P. 476-481.
41. Mathei et al. Hepatitis B vaccine administration: comparison between jet-gun and syringe and needle // Vaccine. – 1997. – V. 15. – P. 402-404.
42. Merdan et al. Prospects for cationic polymers in gene and oligonucleotide therapy against cancer // Adv. Drug. Deliv. Rev. – 2002. – V. 54. – P. 715-758.
43. Morgan R.A., Dudley M.E., Wunderlich J.R., et al. Cancer Regression in Patients After Transfer of Genetically Engineered Lymphocytes // Science. - August 31, 2006. - 10.1126/science.1129003.
44. Mountain A. Gene therapy.- P. the first decade // Trends Biotechnol 2000 Mar; 18 (3.-P.119-28.
45. Porteous D.J., Dorm J.R., McLachlan G., et al. (1997) Gene Ther., 4, 210-218.
46. Riordan J.R., Rommens J.M., Kerem B.S., et al. (1989) Science, 245, 1066-1073.
47. Rommens J.M., lannuzzi M.C., Kerem B.S., et al. (1989) Science, 245, 1059-1064.
48. Searle et al. Adenoviral vectors: not to be sneezed at // Gene Ther. – 1998. - V. 5. - P. 725-727.
49. Teichler Zallen D US gene therapy in crisis // Trends Genet. – 2000. – V. 16. – P. 272-275.
50. Tong Zhu, Liqiao Zhou, Satsuki Mori et al. Sustained Whole-Body Functional Rescue in Congestive Heart Failure and Muscular Dystrophy Hamsters by Systemic Gene Transfer. Circulation. 2005;112:2650-2659.
51. Trezise et al. In vivo DNA electrotransfer // DNA Cell Biol. – 2002. – V. 21. – P. 869-877.
52. Weatherall G.J. (1995) Brit.Med. Bull., 51, 1-11.
53. Whitsett J.A., Dey C.R„ Stripp B.R. et al. (1992) Nat. Genet., 2, 13-20
54. Wolff et al. Expression of naked plasmids by cultured myotubes and entry of plasmids into T tubules and caveolae of mammalian skeletal muscle // J. Cell Sci. – 1992. – V. 103. – P. 1249-1259.
55. Zabner J. Couture L.A., Gregory R.J. et al. (1993) Cell, 75, 207-216.
56. Zelenin et al. Bacterial beta-galactosidase and human dystrophin genes are expressed in mose skeletal muscle fibers after ballistic transfection // FEBS Lett. – 1997. – V. 414. – P. 319-322.
|
|
|


