 |
1) Классификация основных классов неорганических веществ. Составление формул и номенклатура химических соединений.
|
|
|
|
1) Классификация основных классов неорганических веществ. Составление формул и номенклатура химических соединений.
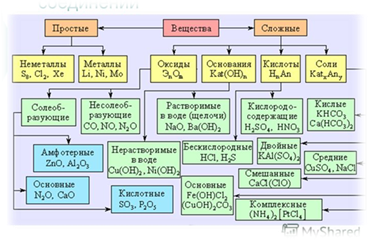
Важнейшими классами неорганических соединений являются оксиды, кислоты, основания и соли.
Оксиды – это сложные вещества, состоящие из двух элементов, один из которых кислород в степени окисления (– 2).
При написании формулы оксида символ элемента, образующего оксид, ставится на первое место, а кислорода – на второе. Общая формула оксидов: ЭхОу.
Особую группу кислородных соединений элементов составляют пероксиды. Обычно их рассматривают как соли пероксида водорода Н2О2, проявляющего слабые кислотные свойства. У пероксидов атомы кислорода химически связаны не только с атомами других элементов, но и между собой (образуют пероксидную группу – О–О–).
По реакционной способности оксиды можно разделить на солеобразующие и несолеобразующие (безразличные). В свою очередь, солеобразующие оксиды подразделяются на основные, кислотные и амфотерные.
Основными называются такие оксиды, которым соответствуют основания. Например, Na2O, CaO являются основными оксидами, так как им соответствуют основания NaOH, Ca(OH)2.
Получение основных оксидов
1. Взаимодействие металла с кислородом.: 4 Li + O2 → 2 Li2O.
2. Разложение при нагревании кислородных соединений: карбонатов, нитратов, оснований.
1. Взаимодействие с водой. По отношению к воде основные оксиды делятся на растворимые и нерастворимые
Na2O + H2O → 2NaOH;
CaO + H2O → Ca(OH)2.
2. Основные оксиды взаимодействуют с кислотами, образуя соль и воду. CaO + H2SO4 → CaSO4 + H2O
3. Основные оксиды взаимодействуют с кислотными, образуя при этом соль
Кислотными называются такие оксиды, которым соответствуют кислоты. Например, CO2, P2O5, SO3 являются кислотными оксидами, так как им соответствуют кислоты H2CO3, H3PO4, H2SO4.
|
|
|
Амфотерными называются такие оксиды, которые в зависимости от условий проявляют основные или кислотные свойства, то есть обладают двойственными свойствами.
1. Амфотерные оксиды не взаимодействуют с водой.
2. Амфотерные оксиды взаимодействуют с кислотами.
Al2O3 + 6 HCl → 2 AlCl3 + 3 H2O
3. Амфотерные оксиды взаимодействуют с основаниями.
Al2O3 + 2 NaOH¾ ¾ ® 2 NaAlO2 + H2O Al2O3 + 2NaOH+ 3H2O® 2Na[Al(OH)4 ]
4. Амфотерные оксиды взаимодействуют с основными и кислотными оксидами.
Al2O3 + 3 SO3 ¾ ¾ ® Al2(SO4)3
Гидроксиды – это сложные многоэлементные химические соединения, в состав которых входят атомы какого-либо элемента, кислорода и водорода. Поэтому гидроксиды делятся на три большие группы:
1. Гидраты кислотных оксидов, называемые кислотами, например, H2SO4.
2. Гидраты основных оксидов, называемые основаниями, например, Ba(OH)2.
3. Гидраты амфотерных оксидов, называемые амфотерными гидроксидами, например, Be(OH)2.
Основания – это электролиты, диссоцирующие в водном растворе с образованием
катиона металла (или иона аммония NH4+) и гидрокс группы. ОН
Способы получения щелочей и оснований
1. Растворимые в воде основания (щелочи) получают при взаимодействии щелочных и щелочно-земельныхметаллов с водой.
2Na + 2Н2O → 2NaOH + H2-
2. Растворимые в воде основания (щелочи) получают при взаимодействии оксидов щелочных и щелочно-земельныхметаллов с водой.
Na2O + H2O → 2NaOH
3. Щелочи можно получить электролизом водных растворов соответствующих солей (Например, гидроксид натрия можно получить электролизом раствора соли NaCl).
2 NaCl + 2 H2O → 2 NaOH + H2- + Cl2- Катод: 2 H2O + 2e– → H2 + 2 OH– Анод: 2 Cl– – 2e– → Cl2
4. Малорастворимые или нерастворимые в воде основания получают путем взаимодействия растворов соответствующих солей с растворами щелочей.
|
|
|
Кислоты – это электролиты, диссоцирующие в водном растворе с образованием катиона
водорода Н+ и аниона кислотного остатка.
По химическому составу, а именно по отсутствию или наличию атомов кислорода в молекулах, кислоты делятся на кислородсодержашие (H2SO4, HNO3) и бескислородные (H2S, HF, HCl).
Способы получения кислот
1. Взаимодействие кислотного оксида с водой
Исключение составляют SiO2, TeO2, TeO3, MoO3, WO3, которые с водой не взаимодействуют. 2. Если кислотный оксид не растворим в воде, то соответствующие им кислоты получают
косвенным путем, а именно, действием другой кислоты на соответствующую соль.
3. Бескислородные кислоты получают путем взаимодействия неметаллов с водородом с последующим растворением продуктов в воде.
Соли – это электролиты, диссоцирующие в водном растворе с образованием катионов
основных остатков и анионов кислотных остатков.
Соли подразделяются на средние, кислые и основные.
Химическая формула - изображение состава вещества с помощью символов химических элементов, числовых индексов и некоторых других знаков.
 имическая формула - изображение состава вещества с помощью символов химических элементов, числовых индексов и некоторых других знаков.
имическая формула - изображение состава вещества с помощью символов химических элементов, числовых индексов и некоторых других знаков.
|
|
|


