 |
Закон сохранения массы. Закон постоянства состава. Закон постоянства состава (Ж.Л. Пруст, 1801—1808гг.) — любое определенное химически чистое соединение независимо от способа его получения состоит из одних и тех же химических элементов, причем отношения и
|
|
|
|
Закон сохранения массы.
Масса веществ, вступающих в химическую реакцию, равна массе веществ, образующихся в результате реакции.
Закон сохранения массы является частным случаем общего закона природы – закона сохранения материи и энергии. На основании этого закона химические реакции можно отобразить с помощью химических уравнений, используя химические формулы веществ и стехиометрические коэффициенты, отражающие относительные количества (число молей) участвующих в реакции веществ.
Закон постоянства состава
Закон постоянства состава (Ж. Л. Пруст, 1801—1808гг. ) — любое определенное химически чистое соединение независимо от способа его получения состоит из одних и тех же химических элементов, причем отношения их масс постоянны, а относительные числа их атомов выражаются целыми числами.
Закон Авогадро
Следствия закона
Первое следствие из закона Авогадро: один моль любого газа при одинаковых условиях занимает одинаковый объём..
Второе следствие из закона Авогадро: молярная масса первого газа равна произведению молярной массы второго газа на относительную плотность первого газа по второму.
уравнению состояния идеального газа или Уравнения Клапейрона-Менделеева.
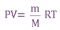

Бойля - Мариотта при постоянной температуре t°, давление, производимое данной массой газа, обратно пропорционально объему газа:

- Гей - Люссака при постоянном давлении объем газа изменяется прямо пропорционально абсолютной температуре:
 .
.
- Шарля: при постоянном объеме давление газа изменяется прямо пропорционально абсолютной температуре.
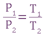
- Объединенный закон Бойля - Мариотта, Гей - Люссака и Шарля:
|
|
|
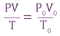
8. Определение молярных масс эквивалентов простых и сложных веществ, веществ в реакциях. Закон эквивалентов.
Эквивалентом вещества называется такое его количество, которое соединяется с 1 молем атомов водорода или замещает то же количество атомов водорода в химических реакциях.
Эквивалентной массой называется масса 1 эквивалента вещества.
Молярный объем эквивалента представляет собой объем одного моль эквивалентов газообразного вещества при нормальных условиях.
законом эквивалентов (И. Рихтер. ). массы реагирующих друг с другом веществ пропорциональны молярным массам их эквивалентов.
Закон эквивалентов можно записать в следующем виде:
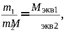
9. Определение и основные понятия термодинамики, химическая термодинамика (термодинамическая система, фаза, компонент, энергия). Классификация и свойства термодинамических систем.
Химическая термодинамика изучает законы взаимного превращения различных видов энергии, состояние равновесия, а также возможность, направление и предел протекания самопроизвольных процессов. Вопрос о скорости протекания химических процессов термодинамика не рассматривает. Химическая термодинамика основана на трех законах (постулатах), иначе называемых началами термодинамики. Эти законы не доказываются, а являются обобщением множества опытных данных, накопленных человечеством. На основе этих законов получены многочисленные следствия, которые лежат в основе строгого описания окружающего нас мира.
Термодинамическая система – это совокупность материальных объектов, выбранных нами произвольно для изучения, которая отделена от всего окружающего (называемого внешней средой) некоторой границей (условной или реальной).
Изолированная система – это система, которая не может обмениваться с окружающей средой ни веществом, ни энергией и имеет постоянный объем.
|
|
|
Закрытая система – это система, которая не может обмениваться с окружающей средой веществом (т. е. имеет постоянную массу), но может обмениваться энергией (в форме теплоты или работы).
Открытая система – это система, которая может обмениваться с окружающей средой и веществом, и энергией.
Кроме того, системы могут быть гомогенными (однородными), которые состоят из одной фазы, и гетерогенными(неоднородными), состоящими из двух или более фаз.
Термодинамические параметры состояния системы – (температура, объем, давление и т. д. ) – это определенные измеряемые свойства системы, характеризующие ее состояние.
Состояние системы – это совокупность термодинамических параметров системы.
Энергия – мера способности системы совершать работу.
Фаза – это гомогенная часть гетерогенной системы, имеющая одинаковый состав, физические и химические свойства, отделённая от других частей системы поверхностью, при переходе через которую свойства системы меняются скачком. Фазы бывают твёрдые, жидкие и газообразные. Гомогенная система всегда состоит из одной фазы, гетерогенная – из нескольких. По числу фаз системы классифицируются на однофазные, двухфазные, трёхфазные и т. д.
Компонент – всякое вещество, входящее в систему, которое из неё можно выделить и которое может существовать отдельно от системы. По числу компонентов системы классифицируются на однокомпонентные, двухкомпонентные, трёхкомпонентные и т. д.
|
|
|


