 |
Химическая связь между ионами называется ионной.
|
|
|
|
Ионы -это заряженные частицы, в которые превращаются атомы в результате отдачи или присоединения электронов.
Ионная связь характерна между атомами металлов и неметаллов, при этом электроны перемещаются из внешнего слоя металлов во внешний слой неметаллов.
Те атомы, которые легко теряют электроны и становятся положительными ионами, условно называют электроположительными, тогда как атомы, принимающие электроны, условно называют электроотрицательными. Например:
Электроположительность Мg равна +2; электроотрицательность О равна – 2.
Ионных соединений сравнительно немного. Ионная связь в молекулах солей, щелочей, основных оксидов: NaF, NaCl, Na2O, MgO, Ca(OH)2 и др.
Классификация ионов:
1. Простые (Cl-, K+)
2. Сложные(NO3-SO42-)
3. Гидратированные (в растворах и кристаллогидратах – CuSO4·5H2O)
4. Негидратированные (безводные соли – CuSO4)
5. Катионы – положительно заряженные частицы (H+, Na+, K+, Cu2+)
6. Анионы – отрицательно заряженные частицы (Cl-,SO42-, PO43-, OH-)
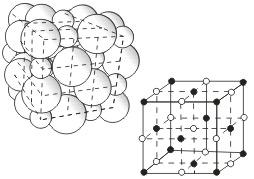
Кристаллические решетки, состоящие из ионов, называются ионными. Их образуют вещества с ионной связью. Примером может служит кристалл хлорида натрия, в котором, как уже отмечалось, каждый ион натрия окружен шестью хлорид-ионами, а каждый хлорид-ион - шестью ионами натрия. Такому расположению соответствует наиболее плотная упаковка, если ионы представить в виде шаров, размещенных в кристалле. Очень часто кристаллические решетки изображают, как показано на рис, где указывается только взаимное расположение частиц, но не их размеры.
Число ближайших соседних частиц, вплотную примыкающих к данной частице в кристалле или в отдельной молекуле, называется координационным числом.
В решетке хлорида натрия координационные числа обоих ионов равны 6. Итак, в кристалле хлорида натрия нельзя выделить отдельные молекулы соли. Их нет. Весь кристалл следует рассматривать как гигантскую макромолекулу, состоящую из равного числа ионов Na+ и Cl-, NanCln, где n - большое число. Связи между ионами в таком кристалле весьма прочны. Поэтому вещества с ионной решеткой обладают сравнительно высокой твердостью. Они тугоплавки и малолетучи.
|
|
|
Плавление ионных кристаллов приводит к нарушению геометрически правильной ориентации ионов относительно друг друга и уменьшению прочности связи между ними. Поэтому расплавы их проводят электрический ток. Ионные соединения, как правило, легко растворяются в жидкостях, состоящих из полярных молекул, например в воде.
Металлическая связь. Металлическая кристаллическая решетка и металлическая химическая связь. Физические свойства металлов. Водородная связь. Водородная связь, ее роль в формировании структур биополимеров.
Если ионная, ковалентная, металлическая химические связи являются внутримолекулярными, то особый вид межмолекулярного взаимодействия представляет водородная связь.
Название этого типа связи показывает, что в ее образовании принимает участие атом водорода. Водородная связь может рассматриваться как некоторая дополнительная связь, которую проявляет атом водорода, уже связанный в молекуле ковалентной связью с другим атомом.
Атом водорода образует водородную связь лишь с атомами определенных элементов, к которым относятся атомы Р, С1, О, S, N. Эти атомы сильно стягивают на себя общую электронную пару, что вызывает появление у них эффективного отрицательного заряда и приводит к превращению атома водорода в протон, почти лишенный электрона.
В отличие от других положительных ионов положительный ион водорода не имеет электронов, поэтому не отталкивается электронными облаками названных выше отрицательно заряженных атомов, а только притягивается. Так как размеры протона во много раз меньше размеров других ионов, то это позволяет ему ближе подходить к другим частицам. Водородная связь и является причиной ассоциации молекул некоторых водородных соединений. Так, например, во фтороводороде существуют не только молекулы НF, но и ассоциированные агрегаты (НF)2 и (НF)3:
|
|
|
В обычной воде за счет водородной связи существуют ассоциированные молекулы состава (Н2О)n, где: n — 2, 3, 4, 5…
Простые молекулы H2O существуют в парообразном состоянии.
Существование ассоциатов у воды и является причиной различных аномалий воды.
Водородной связью называется химическая связь, образованная атомом водорода, связанного с атомом другого элемента, который обладает большим значением электроотрицательности.
· Водородная связь обозначается пунктирной линией.
· Водородную связь могут иметь разнородные молекулы.
· Например: воды и спирта:
· Водородная связь менее прочная, чем ковалентная связь.
Металлическая связь.
Элементы, атомы которых легко теряют электроны, образуют металлическую связь. Таким свойством обладают металлы. Однако и у неметаллов при известных условиях, например у фосфора при сверхвысоком давлении, атомная связь переходит в металлическую связь. У металла висмута в твердом состоянии наряду с металлической связью имеется атомная связь.
При достаточном сближении атомов металла происходит их взаимодействие, при этом электроны утрачивают связи со своими атомами и становятся общими для всего комплекса. Следовательно, металлическая связь проявляется в твердом и жидком состоянии металла, тогда как в газообразном состоянии молекулы металла представляют собой отдельные атомы, почти не действующие друг на друга.
В металлах имеются положительно заряженные ионы, атомы и перемещающиеся между ними общие «полусвободные» электроны. Эти«полусвободные» электроны легко подвижны, непрочно связаны с томом и становятся одновременно общими для всех атомов. Поэтому металлы характеризуются высокой электрической проводимостью и теплопроводностью, сравнительно легко излучают электроны при нагревании и облучении их светом.
|
|
|
Химическая связь, основанная на обобществлении валентных электронов, принадлежащих всем атомам в кристалле, получила название металлической связи.
Металлической связью называют связь в металлах и сплавах между атом-ионами металлов, осуществляемую относительно свободными общими валентными электронами
Металлическая связь довольно прочная, особенно в тяжелых металлах, чем объясняются их высокие температуры плавления и кипения.
Агрегатные состояния веществ и. Твердое, жидкое и газообразное состояния веществ. Переход вещества из одного агрегатного состояния в другое. Чистые вещества и смеси. Понятие о смеси веществ. Гомогенные и гетерогенные смеси. Состав смесей: объемная и массовая доли компонентов смеси, массовая доля примесей.
Все вещества могут существовать в трех агрегатных состояниях - твердом, жидком и газообразном.
Газ - агрегатное состояние вещества, в котором частицы не связаны или весьма слабо связаны силами взаимодействия; кинетическая энергия теплового движения его частиц (молекул, атомов) значительно превосходит потенциальную энергию взаимодействий между ними, поэтому частицы движутся почти свободно, целиком заполняя сосуд, в котором находятся, и принимают его форму. Любое вещество можно перевести в газообразное, изменяя давление и температуру.
Жидкость - агрегатное состояние вещества, промежуточное между твердым и газообразным. Для нее характерна большая подвижность частиц и малое свободное пространство между ними. Это приводит к тому, что жидкости сохраняют свой объем и принимают форму сосуда. В то же время жидкость обладает рядом только ей присущих свойств, одно из которых - текучесть.
В жидкости молекулы размещаются очень близко друг к другу. Поэтому плотность жидкости гораздо больше плотности газов (при нормальном давлении). Свойства жидкости по всем направлениям одинаковы (изотропны) за исключением жидких кристаллов.
При нагревании или уменьшении плотности свойства жидкости, теплопроводность, вязкость меняются, как правило, в сторону сближения со свойствами газов.
|
|
|
Тепловое движение молекул жидкости состоит из сочетания коллективных колебательных движений и происходящих время от времени скачков молекул из одних положений равновесия в другие. При наличии внешней силы, сохраняющей свое направление более длительное время, чем интервалы между скачками, молекулы перемещаются в направлении этой силы, что и приводит к текучести жидкости.
Твердые тела - агрегатное состояние вещества, характеризующееся стабильностью формы и характером теплового движения атомов. Это движение вызывает колебания атомов (или ионов), из которых состоит твердое тело. Амплитуда колебаний обычно мала по сравнению с межатомными расстояниями.
Структура твердых тел многообразна, но, тем не менее, их можно разделять на кристаллы и аморфные тела.
В кристаллах атомы (или ионы) расположены в пространстве в узлах кристаллической решетки и колеблются около них. Строгая периодичность в расположении атомов приводит к сохранению порядка на больших расстояниях.
В аморфных телах атомы колеблются около хаотически расположенных точек. Свойства аморфных тел: они изотропны, не имеют постоянной температуры плавления, обладают текучестью.
По типам химической связи твердые тела делят на три класса, каждый из которых характеризуется определенным пространственным распределением электронов: 1) ионные кристаллы (NaCl, KaCl); 2) ковалентные (алмаз, Ge, Si); 3) металлические.
Кристаллическая структура твердых тел зависит от сил, действующих между атомами и частицами. Одни и те же атомы могут образовывать различные структуры - серое и белое олово, графит и алмаз.
Полиморфизм - способность некоторых веществ существовать в состояниях с различной атомно-кристаллической структурой (сера, кремнезем имеют более чем две полиморфные модификации).
Одиночные кристаллы называют монокристаллами. У монокристаллов некоторые свойства анизотропны, т. е. зависят от направления (механические, оптические и электрические). Естественная анизотропия - характерная особенность кристаллов; например, пластинка слюды легко расщепляется на тонкие листочки вдоль определенной плоскости (параллельно этой плоскости силы сцепления между частицами слюды наименьшие).
Твердое тело, состоящее из большого числа маленьких кристаллов, называют поликристаллическим. Поликристаллические материалы изотропны.
|
|
|


