 |
53. Конкурентные и неконкурентные схемы ИФА.
|
|
|
|
52. Кинетические закономерности протекания ферментативных реакций. (Уравнение Михаэлис-Ментен и Бригс-Холдейна. Понятие о максимальной скорости ферментативной реакции (Vmax) и константе Михаэлиса (Кm)).
Уравне́ ние Михаэ́ лиса— Ме́ нтен — основное уравнение ферментативной кинетики, описывает зависимость скорости реакции, катализируемой ферментом, от концентрации субстрата. Уравнение названо в честь физикохимиков Леонора Михаэлиса и Мод Леоноры Ментен. Простейшая кинетическая схема, для которой справедливо уравнение Михаэлиса:

Уравнение имеет вид:
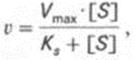 ,
,
где
·  — максимальная скорость реакции при насыщении фермента субстратом;
— максимальная скорость реакции при насыщении фермента субстратом;
· Кs— константа диссоциации фермент-субстратного комплекса.
· 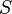 — концентрация субстрата.
— концентрация субстрата.
· V – наблюдаемая скорость реакции при данной концентрации субстрата.

Кривая уравнения Михаэлиса-Ментен: гиперболическая зависимость начальных скоростей катализируемой ферментом реакции от концентрации субстрата.
Из уравнения Михаэлиса–Ментен следует, что при высокой концентрации субстрата и низком значении KS скорость реакции является максимальной, т. е. v = Vmax(реакция нулевого порядка). При низкой концентрации субстрата, напротив, скорость реакции оказывается пропорциональной концентрациисубстрата в каждый данный момент (реакция первого порядка).
Следует указать, что уравнение Михаэлиса–Ментен в его классическом виде не учитывает влияние на скорость ферментативного процесса продуктов реакции, например в реакции
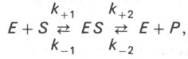
и носит несколько ограниченный характер. Поэтому были предприняты попытки усовершенствовать его. Так, было предложено уравнение Бриггса-Холдейна:
|
|
|

где Кm представляет собой константу Михаэлиса, являющуюся экспериментально определяемой величиной. Она может быть представлена следующим уравнением:

В числителе представлены константы скоростей распада комплекса ES в двух направлениях (в сторону исходных Е и S и в сторону конечных продуктов реакции Е и Р). Отношение k–1/ k+1представляет собой константу диссоциации ферментсубстратного комплекса KS, тогда:

Отсюда вытекает важное следствие: константа Михаэлиса всегда больше константы диссоциации фермент-субстратного комплекса KSна величинуk+2/k+1.
Для определения численного значения Кm обычно находят ту концентрацию субстрата, при которой скорость ферментативной реакции v составляет половину от максимальной Vmax, т. е. если v =1/2Vmaх. Подставляя значение v в уравнение Бриггса–Холдейна, получаем:
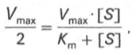
разделив обе части уравнения на Vmах, получим

Таким образом, константа Михаэлиса численно равна концентрации субстрата (моль/л), при которой скорость данной ферментативной реакции составляет половину от максимальной.
Пользоваться графиком, построенным в прямых координатах зависимости начальной скорости реакции v0 от начальной концентрации субстрата [S0], неудобно, поскольку максимальная скорость Vmax является в данном случае асимптотической величиной и определяется недостаточно точно.
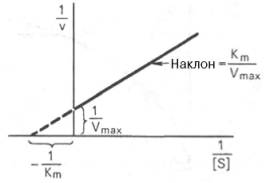
График Лайнуивера-Бэрка.
53. Конкурентные и неконкурентные схемы ИФА.
Если на первой стадии в системе присутствует только анализируемое соединение и соответствующие ему центры связывания, то метод неконкурентный.
Если – одновременно анализируемое вещество и его аналог, то метод конкурентный. Необходимое условие – недостаток центров специфического связывания по отношению к веществу и аналогу.
|
|
|


