 |
Задача 1. (Авторы – Р.Р. Файзуллин, И.А. Седов)
|
|
|
|
1. При прокаливании происходят следующие реакции:
Zn(OH)2 = ZnO + H2O
ZnCO3 = ZnO + CO2
По 1,5 балла за каждое уравнение, всего 3 балла.
2. В газовой фазе будет находиться смесь углекислого газа (мольную долю которого обозначим x) и водяного пара (мольная доля 1– x). По закону идеального газа ρ RT / p = m /ν = xM (CO2) + (1– x) M (H2O). Отсюда получаем: 44 x + 18(1– x) = 0,62∙8,314∙573/101,3 = 29,2; x = 0,43.
Мольные доли карбоната и гидроксида цинка равны мольным долям углекислого газа и воды соответственно. Массовая доля карбоната составляет ω = (0,43∙125,5)/(0,43∙125,5 + 0,57∙99,5) = 0,49 или 49%.
Баллов за верный ответ, подтвержденный расчетом, 5 баллов за верный расчет состава газовой смеси при неправильном ответе.
Всего максимум 10 баллов
Задача 2. (Автор – Р.Р. Файзуллин)

По 2 балла за верную структуру каждого из соединений A, B и заместителей X, Y, R.
Всего максимум 10 баллов
Задача 3. (Автор – М.А. Зиганшин)
1. C3H8 + 5O2 = 3CO2 + 4H2O
ΔН0 = 4∙(–241,8) +3∙(–393,5) – (–104,6) = – 2043,1 кДж
2C4H10 + 13O2 = 8CO2 + 10H2O
ΔН0 = 8∙(–393,5) +10∙(–241,8) – 2∙(–126,1) = – 5313,8 кДж (на 1 моль – 2656,9 кДж).
По 1 баллу за уравнения реакций, всего 2 балла, по 1,5 балла за расчет энтальпий, всего 3 балла.
2. При сгорании 1 моль газовой смеси выделится теплота:
Q1 = 0,6∙2043,1 + 0,4∙2656,9 = 2288,6 кДж.
Для нагрева 3 л воды нужна теплота:
Q2 = 3000/18∙75,3∙(25–5)/1000 = 251 кДж.
Для нагревания 3 л воды потребуется Q2/Q1 = 0,11 моль или 0,11∙22,4 = 2.5 л газовой смеси.
За верный расчет объема 5 баллов.
Всего максимум 10 баллов
Задача 4. (Автор – М.В. Ефимов)
1.
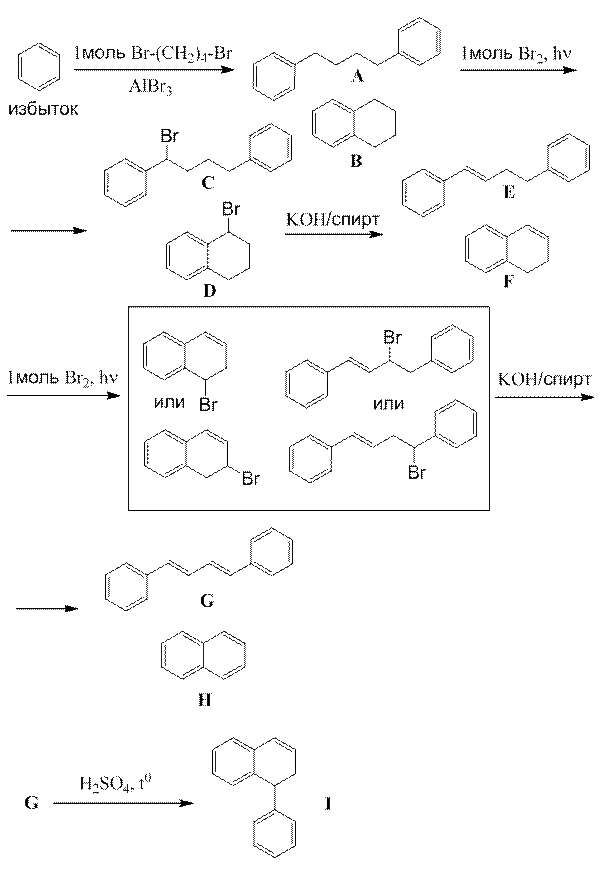
По 1 баллу за каждую из структур, всего 9 баллов.
2. Нафталин не применяется из-за его канцерогенных и токсических свойств (1 балл).
|
|
|
Всего максимум 10 баллов
Задача 5. (Автор – И.А. Седов)
1. 2КMnO4 + 5H2O2 + 3H2SO4 = K2SO4 + 2MnSO4 + 8H2O + 5O2
Количество прореагировавшего перманганата калия равно сV /1000 моль, а перекиси водорода – 5 сV /2000 моль. Массовая доля перекиси равна w (H2O2) = 5 сV /2000·34/ m ·100% = 8,5 сV / m.
Баллов за верный вывод формулы.
2. Подставляя в формулу данные задачи, получим w (H2O2) = 27,2%. Это связано с тем, что при хранении, особенно на свету, перекись водорода разлагается с образованием кислорода и воды:
2Н2О2 = 2Н2О + О2
Балла за значение концентрации, 2 балла за объяснение.
Всего максимум 10 баллов
Класс Район 2011-2012
Задача 1. Смесь двух углеводородов A и B с плотностью по воздуху 1,425 была пропущена через бромную воду. При этом объём смеси уменьшился в 3 раза, а плотность возросла на 6,45%. Углеводород А при пропускании над нагретым активированным углем образует вещество C.
1. Напишите структурные формулы веществ A – C. Приведите их названия по номенклатуре ИЮПАК.
Под действием подкисленного водного раствора сульфата ртути (II) A может превращаться в вещество D. Восстановление D водородом в присутствии катализатора дает продукт E, реагирующий с натрием с образованием вещества F.
2. Напишите структурные формулы веществ D – F.
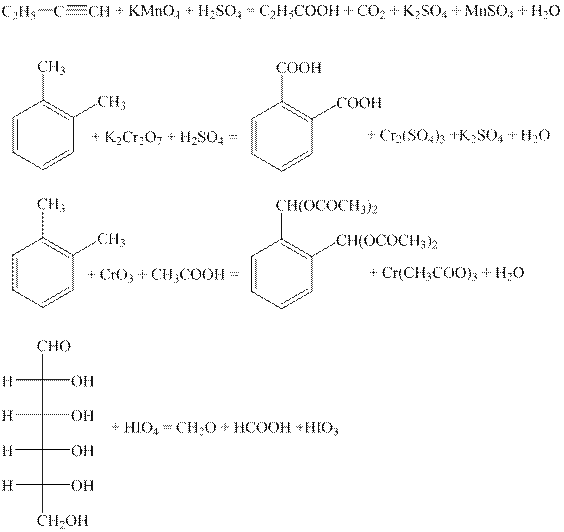
Задача 2. Расставьте коэффициенты в уравнениях реакций:
Задача 3. Простое вещество A, образованное самым распространенным элементом во Вселенной, взаимодействует со взрывом с простым веществом B с образованием продукта C. Водный раствор C окрашивает индикаторную бумагу в красный цвет. Вещество B даже при комнатной температуре реагирует с водой с образованием веществ C и D. При пропускании мощных электрических разрядов через смесь B и D в объемном соотношении 3:2 при низкой температуре образуется соединение E, которое является одним из наиболее сильных из известных окислителей. E содержит 44,2% элемента, образующего простое вещество B.
|
|
|
Напишите формулы соединений A-E и уравнения всех упомянутых реакций.
Задача 4. Каликсарены представляют собой органические соединения, способные образовывать устойчивые комплексы с другими органическими молекулами. Состав этих комплексов можно выразить общей формулой Calix· n M, где Calix – молекула каликсарена, M – органическая молекула, n – число молекул M, связанных с одной молекулой каликсарена. Например, комплекс с пентаном имеет состав Calix·C5H12.
Перед вами – структурная формула трет-бутилкаликс[4]арена:

1. Напишите брутто-формулу трет-бутилкаликс[4]арена.
По данным элементного анализа комплекс трет-бутилкаликс[4]арена с хлороформом содержит 56,055% C, 5,905% H, 6,355% O, 31,684% Cl.
2. Определите состав комплекса трет-бутилкаликс[4]арена с хлороформом.
Трет-бутилкаликс[4]арен образует два комплекса с бензолом различного состава. Комплекс I при нагревании теряет 5,68% массы в интервале температур 90–140°С, при дальнейшем нагревании масса не изменяется вплоть до 340°С, когда начинается разложение каликсарена.
3. Определите с помощью расчета состав комплекса I.
При исследовании комплекса II трет-бутилкаликс[4]арена с бензолом в герметичную ячейку с 0,12 г твердого каликсарена было помещено 20 мкл бензола (плотность 0,879 г/мл), после установления равновесия в газовой фазе при температуре кипения бензола находилось 3,1 мг паров бензола.
4. Определите с помощью расчета состав комплекса II.
Задача 5.
Маленький мальчик прошел на республиканскую олимпиаду по химии. На экспериментальном туре ему выдали 10 пронумерованных неподписанных пробирок, каждая из которых содержала бесцветный водный раствор одного из следующих веществ (никакие две пробирки не содержали одинаковые растворы): сульфат магния, сульфат калия, хлорид бария, хлорид алюминия, хлорид цинка, хлорид марганца, хлорид калия, бромид калия, иодид калия и нитрат серебра, а также подписанную пробирку с раствором аммиака и пустые пробирки. Требовалось определить содержимое каждой из пробирок.
Мальчик налил во все пронумерованные пробирки раствор аммиака, при этом в пробирке 1 сначала выпал белый осадок, который растворился в избытке аммиака, в пробирке 9 сначала выпал бурый осадок, который растворился в избытке аммиака, а в пробирках 2, 3 и 5 выпал белый осадок, не растворившийся при добавлении избытка аммиака, причем осадок из пробирки 5 со временем приобрел темную окраску. Полученный раствор из пробирки 9 мальчик добавил в пробирки 4, 6, 7, 8 и 10, при этом осадок выпал только в пробирке 8. Затем мальчик прилил раствор из пробирки 4 в пробирки 6, 7 и 10, но никаких видимых изменений не наблюдалось. После этого он прилил раствор из пробирки 10 в пробирки 6 и 7, и в пробирке 7 выпал осадок. Тот же раствор из пробирки 10 мальчик добавил в пробирки 2 и 3, после чего в пробирке 3 выпал дополнительный объем осадка. В итоге мальчик верно определил содержимое всех пробирок, кроме 4 и 6.
|
|
|
1. Определите содержимое всех пронумерованных пробирок (кроме 4 и 6). Напишите уравнения всех проведенных реакций.
2. Какую грубую ошибку допустил мальчик?
3. Как можно было различить между собой вещества в пробирках 4 и 6?
Класс Решения 2011-2012
Задача 1. (Автор – А.К. Гатиатулин)1. После пропускания через бромную воду молярная масса газа составила 1,425·29·1,0645 = 44 г/моль. Значит, один из углеводородов пропан C3H8, который не реагирует с бромом. Молярная масса M второго компонента смеси должна удовлетворять условию: 1,425·29 = 44·(1/3) + M ·(2/3). Отсюда M = 40 г/моль, что соответствует пропину или пропадиену, однако для последнего не пойдет реакция с подкисленным раствором сульфата ртути и нехарактерны превращения над активированным углем. За каждую верную молярную массу по 1 баллу, всего 2 балла.
A – CH3–C≡CH, пропин. B – CH3–CH2–CH3, пропан.
С – 1,3,5-триметилбензол
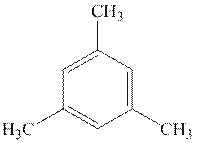
За каждую верные структуры A и B по 1 баллу, за C 1,5 балла, за каждое верное название по 0.5 балла, всего максимум 5 баллов. В случае вещества С 1,2,4-триметилбензол и его структурная формула также засчитывается как правильный ответ.
2. D E F
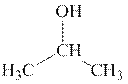
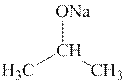
За каждую верную структуру по 1 баллу.
Задача 3. (Автор – А.В. Герасимов)Самым распространенным элементом во Вселенной является водород. Следовательно соединение А – H2. Простое вещество В, при комнатной температуре реагирующее с водой и со взрывом реагирующее с водородом –F2. Следовательно, С – HF, D – O2. При пропускании электрических разрядов через смесь фтора и кислорода при низкой температуре образуется “фторид озона” E состава O3F2. H2 + F2 = 2HF
|
|
|
2F2 + 2H2O = 4HF + O2 2F2 + 3O2 = 2O3F2 За каждую верную формулу A – D 1,5 балла, всего 6 баллов, за формулу E 2,5 балла, за каждое верное уравнение реакции с коэффициентами 0,5 балла, всего 1,5 балла.
Задача 4. (Автор – А.К. Гатиатулин) 1. С44H56O4. (2 балла)
2. Отношение числа атомов хлора к кислороду равно (31,684/35,5):(6,355/16) = 2,25. Формула хлороформа CHCl3, поэтому атомов кислорода в комплексе останется 4, а число атомов хлора 4·2,25 = 9, т.е. каликсарен связал 3 молекулы CHCl3. Состав комплекса Calix∙3CHCl3 (2,5 балла).
3. При нагревании комплекса бензол полностью испаряется, и остается твердый каликсарен. Молярная масса каликсарена равна 44·12 + 56·1 + 4·16 = 648 г/моль. Он связывает 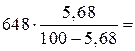 39 г, или 0,5 моля бензола. Поэтому состав комплекса Calix∙0,5C6H6 или 2Calix∙С6H6 (3 балла).
39 г, или 0,5 моля бензола. Поэтому состав комплекса Calix∙0,5C6H6 или 2Calix∙С6H6 (3 балла).
4. Из 0,879·20 = 17,6 мг бензола в ячейке с каликсареном связалось 17,6 – 3,1 = 14,5 мг, или 0,186 ммоль. Количество каликсарена 120/648 = 0,185 ммоль, т.е. связывание произошло в соотношении 1:1. Состав комплекса Calix∙C6H6 (2,5 балла). При отсутствии расчетов за состав комплекса 1 балл.
Задача 5. (Автор – И.А. Седов) 1. При действии раствора аммиака на растворы солей выпадают осадки нерастворимых гидроксидов металлов, а в случае солей серебра образуется бурый осадок оксида серебра, растворимый в избытке аммиака с образованием комплекса [Ag(NH3)2]+, поэтому 9 – AgNO3. В избытке аммиака также растворим белый осадок гидроксида цинка, 1 – ZnCl2. На воздухе темнеет гидроксид марганца, 5 – MnCl2. В пробирка 2 и 3 находятся MgSO4 и AlCl3. Раствор из пробирки 9, содержащий катион [Ag(NH3)2]+, уже не будет давать осадка с сульфатами и галогенидами, кроме иодида. Поэтому 8 – KI. В оставшихся пробирках 4, 6, 7 и 10 находятся KCl, KBr, K2SO4 и BaCl2. Из них только BaCl2 может вызвать выпадение дополнительного объема осадка в растворе, где изначально находился сульфат магния. Он также дает осадок с сульфатом калия. Значит, 10 – BaCl2, 3 – MgSO4, 7 – K2SO4, 2 – AlCl3.
1 – ZnCl2 7 – K2SO4
2 – AlCl3 8 – KI
3 – MgSO4 9 – AgNO3
5 – MnCl2 10 – BaCl2 По 0,7 балла за каждое вещество, всего 5,6
2Ag+ + 2OH– = Ag2O + H2O (или AgOH)
Ag2O + 4NH3 + H2O = 2[Ag(NH3)2]+ + 2OH– (или аналогично с AgOH)
Mg2+ + 2OH– = Mg(OH)2
Zn2+ + 2OH– = Zn(OH)2
Zn(OH)2 + 4NH3 = [Zn(NH3)4]2+ + 2OH–
2Mn(OH)2 + O2 + 2H2O = 2Mn(OH)4 (или MnO(OH)2, или MnO2)
Mn2+ + 2OH– = Mn(OH)2
Al3+ + 3OH– = Al(OH)3
[Ag(NH3)2]+ + I– = AgI + 2NH3
Ba2+ + SO42– = BaSO4
По 0,3 балла за каждое уравнение, всего 3 балла. Если написаны молекулярные уравнения реакций, максимум тоже 3 балла, по 0,3 балла за реакцию.
2. Мальчик должен был смешивать небольшие пробы растворов в чистых пробирках, чтобы оставалось некоторое количество исходных растворов (0,7 балла за верное объяснение ошибки).
|
|
|
3. При добавлении нитрата серебра KBr дает светло-желтый осадок AgBr, а KCl – белый осадок AgCl. (0,7 балла за верный способ различения).
Задача 2. (Автор – И.А. Седов) Наиболее рационально рассуждать так. Потерю атома водорода или присоединение группы OH при окислении можно считать потерей 1 электрона, а присоединение 1 кислорода – 2 электронов. Суммируя эти потери, можно найти общее число отдаваемых органическим соединением “электронов” и уравнять любую реакцию окисления. 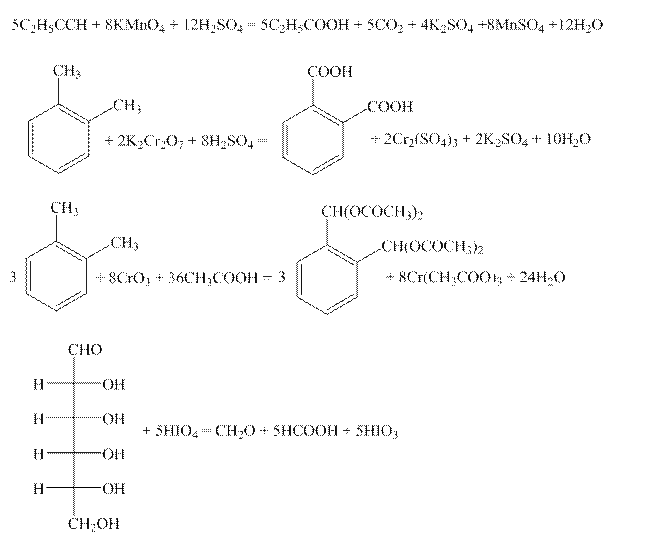
По 2,5 балла за коэффициенты.(Многие орг. ОВР формально можно уравнять несколькими способами, но это не соответствует реальным процессам. Пример – реакция 4: перед HIO3 можно поставить любой коэфф.от 1 до 6. На самом же деле 1 молекула HIO3 тратится на разрыв 1 связи С–С, а всего разрывается 5 связей. За другие формально правильные варианты расстановки коэффициентов 1,5 балла вместо 2,5.)
Класс
Задача 1.
Термическое разложение аммиачной селитры NH4NO3 может протекать по двум путям в зависимости от температуры. При температуре ниже 270 °С происходит образование соединений A и B. При температуре выше 270 °С образуются соединения B, C и D. Соединение A при нагревании взаимодействует с водородом с образованием соединений С и B. B можно получить прямым взаимодействием D с водородом. D при очень высоких температурах реагирует с веществом С с образованием бинарного соединения E, которое при комнатной температуре легко реагирует с D с образованием вещества F.
1. Определите вещества A - F, напишите уравнение всех упомянутых реакций.
2,814 г смеси нитрата и нитрита аммония прокалили до полного исчезновения твердой фазы. Полученную смесь газов охладили до 0°C. При этом объём сконденсировавшейся воды составил 1,42 мл.
2. Найдите массовые доли нитрата и нитрита аммония в смеси.
3. Найдите минимальный и максимальный возможный объём полученной смеси газов при н.у.
Задача 2.
Этилен способен вступать в следующую цепочку превращений:
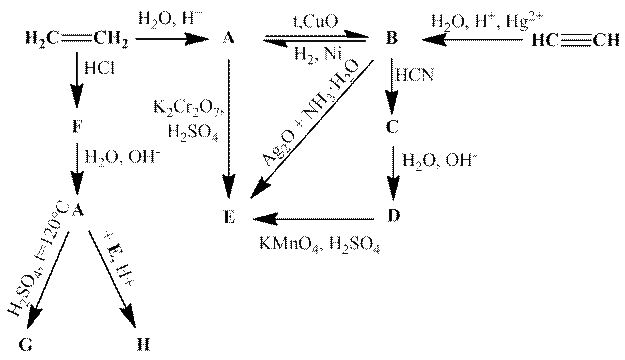
1. Напишите структурные формулы веществ A - H.
2. Напишите уравнения (с коэффициентами) реакций получения E из A, B и D.
3. Приведите формулы всех возможных изомеров соединения G.
Задача 3.
В 1988-м году технический регламент автогонок Формула-1 допускал использование за всю гонку не более 150 литров горючего с октановым числом не более чем в 102 единицы. Фирма Elf разработала несколько образцов горючего с таким октановым числом. Смесь 1 содержала 30% толуола, 4% н-гептана и 66% изооктана (все проценты здесь и далее – объемные). Смесь 2 содержала 60% толуола, 10% н-гептана и 30% изооктана. Смесь 3 содержала 85% толуола и 15% н-гептана.
1. Какая из смесей будет наиболее эффективна в гонке с точки зрения количества энергии, выделяемой при сгорании? Ответ подтвердите расчетом.
Мольные энтальпии сгорания толуола, н-гептана и изооктана составляют –3920, –4466 и –5075 кДж/моль соответственно, а плотности – 0,867, 0,679 и 0,692 г/мл.
2. Какое октановое число имеет смесь, содержащая 5% н-гептана и 95% изооктана?
3. Напишите уравнения реакций полного сгорания каждого компонента.
Задача 4.
Энергию ионизации основного состояния атома водорода можно рассчитать по формуле 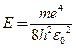 , где m – масса электрона, e – заряд электрона, h = 6,63·10–34 Дж·с (постоянная планка),
, где m – масса электрона, e – заряд электрона, h = 6,63·10–34 Дж·с (постоянная планка),  = 8,85·10–12 Кл2/(Дж·м) (электрическая постоянная).
= 8,85·10–12 Кл2/(Дж·м) (электрическая постоянная).
1. Рассчитайте энергию ионизации основного состояния атома водорода, если известно, что постоянная Фарадея составляет F = 96485 Кл/моль, а масса электрона в 1836 раз меньше массы протона.
2. Ионизацию атома можно произвести с помощью электронного удара электронами, ускоренными разностью потенциалов. Какая минимальная разность потенциалов необходима, чтобы ускоренные электроны могли ионизировать атом водорода?
Задача 5.
Участник международной олимпиады по химии Бо Шин Тан на экспериментальном туре должен был определить концентрацию хлоридов магния и натрия в растворе. Для этого он отобрал 10,0 мл исследуемого раствора и оттитровал его 0.093 М раствором нитрата серебра с индикатором, чувствительным к ионам серебра. На титрование ушло 23,2 мл раствора. Затем он отобрал 20,0 мл исследуемого раствора и оттитровал его 0.0103 М раствором ЭДТА (вещества, образующего комплекс состава 1:1 с ионами магния), добавив индикатор, чувствительный к ионам магния. На титрование ушло 18,6 мл раствора ЭДТА.
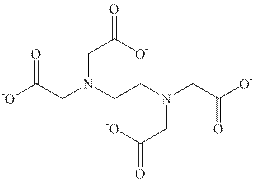
Анион этилендиаминтетрауксусной кислоты (ЭДТА)
1. Напишите уравнения реакций нитрата серебра с хлоридами натрия и магния.
2. Определите концентрации (г/л) хлоридов магния и натрия в исследуемом растворе.
3. Отметьте в формуле ЭДТА кружочками атомы, участвующие в образовании комплекса с магнием.
4. Какой комплекс магния более прочен – с ЭДТА или использованным в титровании индикатором?
Класс
|
|
|


