 |
Коррозионностойкие и хромоникелевые (нержавеющие) стали и сплавы.
|
|
|
|
ОСНОВЫ ТЕОРИИ КОРРОЗИИ
Разрушение металлов и сплавов в результате химического или электрохимического воздействия на их поверхность внешней агрессивной среды называется коррозией.
Коррозия, как правило, сопровождается образованием на поверхности металла продуктов коррозионного разрушения. Так, например, на поверхности сплавов железа в результате коррозии образуется ржавчина, имеющая бурый цвет. В некоторых же отдельных случаях коррозия металлов не сопровождается образованием таких заметных продуктов разрушения и тогда ее появление обнаружить довольно сложно.
Коррозионное разрушение является результатом взаимодействия металла с внешней средой и интенсивность его развития зависит от свойств самого металла, а также от природы окружающей среды. Большинство металлов, будучи стойкими в одних средах, довольно легко разрушается при взаимодействии с другими средами. Например, медные сплавы устойчивы во влажной атмосфере, но сильно подвергаются коррозии, если в атмосфере присутствует даже незначительное количество аммиака; тантал и титан при комнатных температурах весьма стойки во многих агрессивных средах, но приобретают высокую химическую активность при нагреве их выше 600° С.
Различают несколько видов коррозии: сплошную или равномерную, когда коррозии подвергается вся поверхность изделия; точечную или местную, если коррозия развивается на отдельных небольших участках; межкристаллитную коррозию (МКК), когда коррозия распространяется в глубь изделия по границам зерен; коррозия под напряжением — возникновение коррозионных трещин вследствие одновременного воздействия на металл растягивающих напряжений и агрессивной среды.
|
|
|
Коррозия может протекать вследствие чисто химических реакций с окружающей средой, а также вследствие электрохимических процессов, происходящих на границе раздела металла с внешней средой. Наибольшее количество металла разрушается в результате электрохимической коррозии.
Электрохимической коррозией называют разрушение металлов и сплавов при воздействии на них электролитов. Этот тип коррозии характеризуется протеканием электрического тока, переходом атомов в ионизированное состояние и другими электрохимическими процессами.
Наиболее часто встречающимися на практике электролитами являются водные растворы солей, кислот и щелочей. Таким образом, к электрохимической коррозии относится корродирование металлических емкостей, трубопроводов, деталей машин и частей стационарных сооружений под действием кислот, морской, речной, грунтовой и других вод. Наиболее распространенной является атмосферная коррозия.
Если в электролите находятся два металла с различными электродными потенциалами, то металл с более отрицательным электродным потенциалом (анод) непрерывно отдает ионы в раствор (растворяется), а образующиеся избыточные электроны непрерывно перетекают в металл с менее отрицательным электродным потенциалом (катод). Катод в контактной паре не разрушается, электроны из него непрерывно удаляются во внешнюю среду.
Все металлы могут быть расположены в ряд в порядке убывания их электрохимического потенциала:
Металл ……………….... Au Ag Сu Η Ni Fe Ζn Αl
Электродный потенциал, В +1,42 +0,80 +0,34 0 -0,23 -0,44 -0,76 -1,66
В технических металлах и сплавах, являющихся телами поликристаллическими, микроструктура состоит из зерен одной или нескольких фаз, неметаллических включений и т. п. Эти различные структурные составляющие, имеющие разные физико-химические свойства, при контакте с электролитом приобретают неодинаковые по величине и знаку электродные потенциалы и одни из них станут анодами, а другие — катодами. Таким образом, технические металлы и сплавы при воздействии на них электролитов можно рассматривать как многоэлектродные элементы, состоящие из огромного числа микроскопически малых коррозионных гальванических пар — микрогальванопар. Чем сильнее отличаются электродные потенциалы фаз, находящихся в сплаве, тем быстрее происходит его коррозионное разрушение (в частности, дендритная ликвация именно поэтому снижает стойкость против электрохимической коррозии). Отсюда следует, что высокую коррозионную устойчивость могут иметь либо очень чистые металлы, либо сплавы, имеющие однородную (гомогенную) структуру твердого раствора.
|
|
|
Пассивным состоянием называется такое состояние металла (сплава), когда он обнаруживает повышенную коррозионную стойкость (даже практически перестает корродировать) в агрессивной среде. Противоположное состояние, когда этот же металл корродирует, называется активным состоянием.
Экспериментальные данные показывают, что переход металла из активного состояния в пассивное связан с повышением его потенциала. Например, железо в обычном состоянии имеет электродный потенциал —0,4 В, в пассивном состоянии его потенциал может повышаться до +1,0 В.
Влияние легирования. Различают две группы коррозионностойких металлов. Одни металлы хорошо сопротивляются коррозии вследствие их малой химической активности. Другие же, являясь по своей природе активными элементами, приобретают высокую химическую устойчивость, благодаря явлению пассивности. К первой группе относятся платина, палладий, золото, ко второй — хром, титан, алюминий и др. Для увеличения коррозионной стойкости химически активного металла в него вводят легирующие элементы.
При легировании какого-либо металла другим, более благородным металлом вначале потенциал сплава практически не изменяется. Но при достижении определенной концентрации происходит скачок потенциала и коррозионная стойкость сплава в данной среде также увеличивается скачком, появляются границы (пороги) устойчивости.
|
|
|
Экспериментально было установлено, что такие резкие изменения устойчивости наступают при кратном 8 соотношении атомов легирующего элемента к легируемому, т. е. n/8, где n — целое число 1, 2, 3... Это соответствует 12, 5; 25; 37,5...% (ат.) легирующего элемента.
Появление границ устойчивости объясняется тем, что при взаимодействии сплава с агрессивной средой часть атомов основного металла переходит в раствор, а оставшиеся атомы более благородного или легко пассивирующего металла образуют на поверхности металла как бы барьер. Этот барьер состоит или из самих атомов благородного металла, или из защитных экранирующих пленок.
В более активных средах требуется более высокая концентрация устойчивого элемента, т. е. в этом случае границы устойчивости возникают при более высоком значении числа п.
Граница устойчивости наблюдается также в сплавах, у которых один из компонентов обладает способностью к самопассивированию. Эта граница наблюдается и в системах, когда один из компонентов в данной агрессивной среде образует защитные экранирующие пленки из нерастворимых соединений.
Коррозионная стойкость стали может быть повышена, если во-первых, содержание углерода снизить до минимально возможного количества и, во-вторых, ввести легирующий элемент, образующий с железом твердые растворы, в таком количестве, при котором скачкообразно повысится электродный потенциал сплава.
Сталь, стойкую против атмосферной коррозии, называют нержавеющей. Сталь или сплав, имеющие высокую стойкость при коррозионном воздействии кислот, солей, щелочей и других агрессивных сред, называют кислотостойкими.
ХРОМОНИКЕЛЕВЫЕ НЕРЖАВЕЮЩИЕ СТАЛИ
Никель относится к числу металлов, легко приобретающих пассивность, хотя его пассивирующая способность меньше хрома и молибдена. Добавление никеля к железу в количестве 1/8 моля скачкообразно улучшает коррозионную стойкость сплава в серной кислоте. При концентрации никеля 2/8 моля коррозионная стойкость повышается еще больше.
Диаграмма состояния железо— никель. Никель — аустенитообразующий элемент, сильно понижающий критические точки γ-να-превращения. Это влияние никель оказывает и при его введении в хромистые стали. Поэтому сталь, содержащая 18% Сr и 9%Ni, при комнатных температурах имеет структуру аустенита (см. рис. 2).
|
|
|
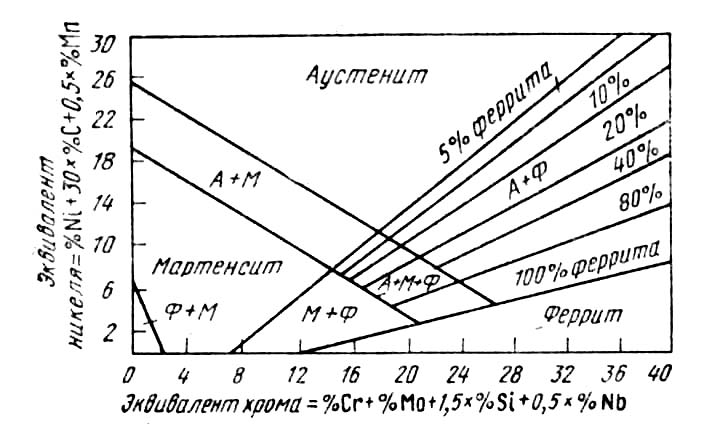
Рис. 2. Структурная диаграмма нержавеющих сталей
Нержавеющие стали, имеющие аустенитную структуру, обладают более высокой коррозионной стойкостью,
лучшими технологическими свойствами по сравнению с хромистыми нержавеющими сталями, в частности лучше свариваются. Они сохраняют прочность до более высоких температур, менее склонны к росту зерна при нагреве и в то же время аустенитные стали не теряют пластичности при низких температурах. Как и хромистые, хромоникелевые стали коррозионностойки в окислительных средах. Основным элементом, повышающим потенциал железа, также является хром, поэтому его содержание должно быть >13%. Никель только дополнительно повышает коррозионную стойкость сталей.
Состав и свойства хромоникелевых нержавеющих сталей приведены в ГОСТ 5632—72. На рис. 2 приведена структурная диаграмма, позволяющая определять структуру стали в зависимости от ее состава.
Хромоникелевые стали в зависимости от состава и структуры подразделяются на стали аустенитного, аустенитно-мартенситного и аустенитно-ферритного классов.
Чем ниже содержание углерода, тем выше коррозионные свойства нержавеющих сталей. Углерод, содержащийся в хромоникелевых сталях, может находиться в твердом растворе, а также в карбидах или карбонитридах различной степени дисперсности. Преимущественно образуются карбиды Сr23С6, причем они образуются уже при содержании углерода немногим больше 0,04% (0,04% С — предел растворимости углерода в аустените, легированном никелем). Если в сталях содержится азот (например, сталь Х17АГ14), то могут образовываться карбонитриды типа Me23(C,N)6 и Me(C,N).
Большинство хромоникелевых нержавеющих сталей относится к аустенитному классу: 04Х18Н10, 12Х18Н9Т, 09Х14Н16Б, 08Х10Н20Т2 и др. Эти стали пластичны, хорошо свариваются, обладают повышенной жаропрочностью, коррозионностойки во многих средах, имеющих среднюю активность. Сталь 12Х18Н10Т — наиболее дешевая и поэтому чаще употребляемая.
Для большей гомогенности хромоникелевые стали подвергают закалке с 1050—1100° С в воде. При этом получают σΒ=50—60 кгс/мм2 и δ=35- 45%. Эти стали упрочняют холодной пластической деформацией.
Дополнительное легирование хромоникелевых сталей молибденом и медью повышает их коррозионную стойкость и кислотостойкость (03Х16Н15МЗ, 03Х17Н14М2). Иногда в эти стали вводят в небольших количествах титан и алюминий, которые, образуя дисперсные интерметаллиды типа Ni3(Ti,Al), упрочняют аустенит (08Х17Н13М2Т, 08Х17Н15МЗТ).
|
|
|
Сталь 06ХН28МДТ (0,06% С; 22-25% Сr; 26— 29% Ni; 2,5-3% Мо; 2,5-3,5% Сu и 0,5-0,3% Ti) обладает высокой коррозионной стойкостью, ее используют в средах высокой агрессивности (разбавленная серная кислота и др.). Эта сталь после закалки с 1100"С в воде имеет структуру аустенита с небольшим количеством карбонитридов. После кратковременных нагревов до 500—900° С не обнаруживает склонности к МКК.
Никель —достаточно дорогой и дефицитный металл, поэтому создают нержавеющие стали с меньшим содержанием никеля. Для этого вводят в состав нержавеющих сталей другие аустенитообразующие элементы, например марганец и даже азот (стали 10Х14Г14Н4Т, 15Х17АГ14, 10Х14АГ15 и др.).
Аустенитно-мартенситные стали (стали переходного класса) имеют меньшую коррозионную стойкость по сравнению с аустенитными сталями, но превосходят их по прочности (σΒ = 120—130 кгс/мм2). К сталям переходного класса относятся стали 09X15Н8Ю, 09X17Н7Ю, 08Х17Н5МЗ, 20Х13Н4Г9 и др.
Режим термической обработки этих сталей характеризуется большой сложностью: закалка, обработка холодом, отпуск —старение. На рис. 3 приведено влияние различных видов термической обработки на прочность нержавеющих сталей различных классов. Наибольшее упрочнение получают стали переходного класса. Такие стали используют для создания легких конструкций, обладающих высоким сопротивлением коррозионному разрушению.
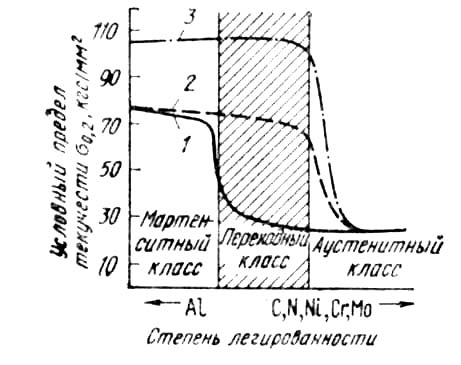
Рис. 3. Влияние термической обработки на прочность нержавеющих сталей:
1 — закалка; 2 — закалка и обработка холодом; 3- закалка, обработка холодом, отпуск (старение)
Аустенитно-ферритные стали предложены как заменители хромоникелевых сталей типа Х18Н8 с целью экономии никеля. К этому классу относятся стали 12Х21Н5Т и 08Х22Н6Т. Аустенитно-ферритные стали при комнатных температурах имеют прочность и твердость выше, чем у стали типа 18-8, но пластичность и ударная вязкость у них ниже. Эти стали не обладают стабильностью свойств: их свойства зависят от соотношения ферритной и аустенитной фаз, которое в свою очередь зависит от суммарного влияния ферритообразующих (Сr, Ti, Mo, Si) и аустенитообразующих (Ni, N2, С) элементов. С увеличением количества феррита жаропрочность сталей уменьшается, прочность увеличивается, пластичность уменьшается, но не ниже 30%. Хорошие технологические свойства получаются при соотношении Φ:А=1: 1.
К этому классу сталей относится и сталь 15Х28АН, обладающая хорошими механическими свойствами
(σΒ= 65—70 кгс/мм2, δ= 11—23%), в том числе и в сварном шве.
Типовая термическая обработка аустенитно-ферритных сталей: закалка с 1000—1150° С и отпуск — старение при 500—750° С.
Аустенитно-ферритные стали не подвержены коррозионному растрескиванию под напряжением: трещины могут возникнуть только на аустенитных участках, но ферритные участки задерживают их развитие.
В нержавеющих сталях наблюдается особый вид коррозии, называемый межкристаллитной коррозией (иногда также называют ее интеркристаллитной). Такая коррозия протекает главным образом по границам зерен и представляет большую опасность, поскольку не имеет каких-либо внешних признаков — металл сохраняет даже металлический блеск. При этом прочность катастрофически падает, исчезает металлический звук, металл настолько легко разрушается, что может быть превращен в порошок. Межкристаллитная коррозия (МКК) развивается в том случае, если изделие из нержавеющей стали после закалки подвергали нагреву до 500—700° С либо если в этом температурном интервале проводили замедленное охлаждение. При этом на электронных микрофотографиях отчетливо видна сетка карбидов хрома.
Причины возникновения МКК изучают много лет и существует несколько теорий, объясняющих причины возникновения этого опасного явления.
Наиболее принятой считается так называемая «теория обеднения». Известно, что граница зерен — это переходная зона между ними.
Если проникновение растворенной примеси в межзеренную зону снижает избыточную энергию границ, концентрация этой примеси в зоне повышается. Установлено, что углерод снижает избыточную энергию границ, поэтому происходит межкристаллитная внутренняя адсорбция углерода по границам зерен нержавеющей стали. Таким образом, уже при закалке атомы углерода неоднородно распределяются в твердом растворе, их концентрация по границам больше, чем в зерне. Хотя при этом не образуется карбидов хрома, однако такая повышенная концентрация углерода является как бы подготовкой для их быстрого образования. При нагреве до 500—700° С по границам зерен образуются карбиды хрома Сг23С6. При этих температурах диффузия углерода, находящегося в твердом растворе, к границам зерен протекает быстрее, чем хрома. Поэтому на образование карбидов расходуется не только имеющийся там запас углерода, но и углерод, диффундирующий изнутри зерен. В то же время хром, необходимый для образования карбидов, поступает, на первых стадиях процесса с границ или из пограничных зон аустенита. В результате содержание хрома в приграничных зонах зерен становится меньше 13% (даже до 6,5%) и они теряют коррозионную стойкость.
Ввиду большой опасности явления МКК все выплавляемые нержавеющие стали обязательно проверяют на склонность к этому виду коррозии. При этом образцы из закаленной стали подвергают провоцирующему отпуску в течение часа при 650° С. После этого образцы кипятят в агрессивной среде и определяют наличие МКК.
Склонность к МКК нержавеющих сталей можно устранить: 1) уменьшением содержания углерода (в сталях, содержащих 0,02% С, МКК не наблюдается); 2) введением элементов — стабилизаторов титана или ниобия, имеющих большее, чем хром, сродство к углероду; 3) применением стабилизирующего отжига (нагрев изделия до 850°С).

Рис. 4. Микроструктура хромоникелевой нержавеющей стали 08Х18Н9 без МКК (а) и с МКК. (б)
При сварке в околошовной зоне металл может нагреваться до опасных температур (500—700° С). Поэтому если сталь склонна к МКК, то из нее не следует делать сварных изделий, либо после сварки необходимо провести термическую обработку, хотя бы отжиг до 650°С. На рис. 4, α приведены микроструктуры нержавеющей стали 08Х18Н9 после термической обработки (закалки с 1100° С в воде), нагрева при 650° в течение часа и кипячения в серной кислоте 48 ч (рис. 4,б).
КОРРОЗИОННОСТОЙКИЕ СПЛАВЫ И ЧУГУНЫ
Кроме нержавеющих сталей, в промышленности используют и другие коррозионностойкие сплавы.
Для особо агрессивных сред применяют сплавы на никелевой основе типа хастеллой (сплавы НИМО). Содержание никеля в этих сплавах достигает 80%. Вторым элементом, присутствующим в этих сплавах в больших количествах, является молибден (15—30%). Состав некоторых сплавов приведен в табл. 1.
Таблица 1.
Химический состав (%) кислотостойких сплавов на никелевой основе типа хастеллой
| Сплав | С | Μn | Si | Сr | Мо | Fe | Другие элементы |
| Хастеллой А (ЭИ460) | <0,12 | <3 | <1 | _ | 20 - 22 | 18 - 20 | |
| Хастеллой В (ЭИ461) | <0,12 | <3 | <1 | <1 | 26 - 30 | 4 - 7 | 0,3V |
| Хастеллой С (ЭП375) | <0,12 | <1 | «1 | 15,5— 17,5 | 16 - 17 | 4,5 -7 | 3,75-5.25W |
| Хастеллой Д | <0,12 | 0,8 -1,25 | 8,5-10 | <1 | _ | <1 | 3,6-6,5Cu |
Эти сплавы обладают очень высокой коррозионной стойкостью в таких средах, где, кроме них, устойчивы лишь немногие металлы (например, в кипящей фосфорной кислоте до концентрации 50%, в кипящей соляной кислоте до 20% и др.).
Сплавы хастеллой обладают высокими механическими свойствами, которые могут быть улучшены термической обработкой — закалкой+старением при 800° С. При этом σв = 120 кгс/мм2 и твердость ΗВ = 360.
Недостатком сплавов является склонность к МКК, поэтому содержание углерода в них должно быть минимальным.
Коррозионностойкие чугуны стойки во многих агрессивных средах (и не только в окислительных). Они, как правило жаростойки. Легированные чугуны дешевле нержавеющих сталей, обладают хорошими литейными свойствами, поэтому изделия из них получают методами литья. Химический состав и свойства кислотостойких чугунов приведены в ГОСТ 2176 и ГОСТ 2233 (табл. 2).
Хромистые чугуны содержат 26—36% Сr. Структура хромистых чугунов — твердый раствор хромистого феррита и эвтектические карбиды. Карбиды могут находиться и в свободном состоянии, причем преимущественно образуются карбиды Сг7С3. Хромистые чугуны (Х34) имеют высокую твердость (НВ 325—400), хорошо сопротивляются износу, но плохо обрабатываются резанием. Сплавы 25X18Л и 30Х20Л по содержанию углерода относятся к сталям, а по свойствам — к чугунам. Литейные и механические свойства у них лучше, чем у Х28 и Х34, они менее склонны к образованию горячих трещин
Таблица2.
Химический состав (%) коррозионностойких чугунов и литых сталей
| Марка | С | Si | Μn | Сr |
| Хромистые чугуны | ||||
| Х28 Х34 | 0,5-1,0 1,5-2,2 | 0,5—0,8 1,3-1,7 | 0,5—0,8 0,5—0,8 | 26—30 32—36 |
| Хромистые стали | ||||
| 25X18Л 30Х20Л | 0,20—0,30 0,25—0,35 | <0,8 <0,8 | <0,8 <0,8 | 17—20 20—23 |
| Высококремнистые чугуны | ||||
| С15 С17 Ф15* | 0,5-0,8 0,3—0,5 0,5—0,0 | 14,5-16 16—18 15—16 | 0,3—0,8 0,3—0,8 0,3—0,8 | _ |
| Никелевые чугуны** | ||||
| СЧЩ-1 СЧ1Д-2 | 3,2—3,5 3,2—3,6 | 1,2-1,5 1,5—2,0 | 0,5—0,8 0,4—0,8 | 0,6—0,8 0,4—0,8 |
* Содержится 3,5—4,5 Мо.
** В сплаве СЧЩ-1 содержится 0,8—1% Ni, в сплаве СЧЩ-2 0,4—0,5% Ni.
Хромистые чугуны стойки в окислительных средах: в азотной кислоте любой концентрации при 20° С и 40%-ной кипящей; в концентрированной серной кислоте и других средах. Окалиностойкость сохраняется до 1000—1100° С.
Из хромистых чугунов изготавливают детали и аппаратуру для азотной промышленности, искусственных удобрений, фильеры и т.д. Используют их и как жаростойкие материалы — для изготовления печного оборудования, колосников, гребков и лопастей в печах, предназначенных для обжига.
Кремнистые чугуны относятся к кислотостойким сплавам. Кремний, как и хром, расширяет область существования феррита и сплавы, содержащие до 14,5% Si, имеют структуру однородного твердого раствора. Содержание углерода в кремнистых чугунах всего лишь 03—0,8%, при большем содержании возможно выделение углерода в виде графита. Чугуны выплавляют с содержанием кремния до 18%, так как при более высоком его содержании эти сплавы становятся хрупкими и их невозможно использовать. При резкой смене температур возможно растрескивание. В окислительных средах на поверхности изделий образуется прочная пленка SiО2, которая восстанавливается при механических повреждениях.
Изделия из кремнистых чугунов изготавливают только литьем, без последующей механической обработки (возможно только шлифование).
Сплав Φ15, называемый также «антихлор», содержит 3,5—4,5% Мо. В результате добавления молибдена сплав устойчив в 10—30%-ных растворах соляной кислоты (до 90° С).
Из кремнистых чугунов изготавливают центробежные насосы, распылители кислот, краны, котлы, чаны и т. д. Все кремнистые чугуны обладают высокой окалиностйкостью.
Никелевые чугуны содержат ~1% Ni (см. табл.2). Эти чугуны.стойки в расплавах солей и в концентрированных растворах щелочей. С увеличением содержания никеля коррозионная стойкость чугунов увеличивается. Состав никелевых чугунов может быть и более сложным: никелькремнистый аустенитный чугун содержит, %: 1,7—2 С; 1,8—3 Сr; 5—7 Si и 16—20 Ni; никельмедистый 2—2,8 С; 3—4 Сr; 5—8 Сu; 1,5—1 Si и 12—5 Ni.
|
|
|


