 |
1. Электродный потенциал
|
|
|
|
Одним из центральных понятий в электрохимии является электродный потенциал, который связан с возникновением двойного электрического слоя на границе металл раствор.
Рассмотрим механизм возникновения электродного потенциала на примере ионно-металлического электрода, который представляет собой металлическую пластину, погруженную в полярную жидкость.
Как известно, в кристаллической решетке металлов находятся как атомы, так и ионы, связанные подвижным равновесием:
 Ме Меn+ + ne-
Ме Меn+ + ne-
где Ме – атом металла, Меn+ - ион металла, n – заряд иона, e- - электрон.
Под действием полярных молекул воды ионы поверхностного слоя металла гидратируются и переходят в раствор, заряжая его положительно, а избыток электронов на металле создают отрицательный заряд. Появление отрицательного заряда на электроде препятствует выходу катионов в раствор, часть же катионов из раствора, взаимодействуя с электронами, входят в узлы кристаллической решетки металла, которую они покинули. При достижении равенства скоростей выхода катионов в раствор и их вхождением в металл устанавливается динамическое равновесие.
 Ме + aq Меn+ · aq + ne- (1)
Ме + aq Меn+ · aq + ne- (1)
где aq – молекулы воды.
Результатом установившегося динамического равновесия является возникновение двойного электрического слоя (рис. 1), который напоминает плоский конденсатор, одна из обкладок которого представлена поверхностью металла, а другая – слоем ионов, находящихся в растворе.
 |
Ме раствор
Рис. 1 Двойной электрический слой на границе раздела фаз
металл – раствор
|
|
|
Однако ионный слой не весь сосредоточен у поверхности металла, а вследствие теплого движения частично размыт в растворе. На границе раздела фаз металл – раствор (как и в случае между обкладками конденсатора) возникает разность электростатических потенциалов, которую называют скачком потенциала или электродным потенциалом.
Аналогичный процесс можно наблюдать и при погружении металла в водный раствор собственной соли. Здесь могут наблюдаться три случая:
1. Вследствие увеличения концентрации катионов в растворе равновесие (1) будет смещено в сторону входа катионов в узлы кристаллической решетки, поэтому отрицательный заряд электрода в растворе собственной соли будет меньше, чем в чистой воде.
2. Изменяя концентрацию соли в растворе, можно добиться того, что образование двойного электрического слоя не произойдет.
3. Малоактивные металлы: медь, серебро, золото, платина и другие характеризуются наличием прочной металлической решетки (высокой энергией связи катиона с электроном). В данном случае окисление металла происходит с трудом, в то время как катионы из раствора активно осаждаются на поверхность металла. Электрод в этом случае заряжается положительно, а раствор отрицательно, из-за избытка оставшихся в нем анионов.
Таким образом, строение двойного электрического слоя, а следовательно, и электродный потенциал зависят от металла, который используют в качестве электрода, концентрации катионов металла в растворе, оказывающей влияние на равновесие (1), и температуры, которая влияет на Кр.
Зависимость электродного потенциала от концентрации катионов в растворе и температуры описывается уравнением:
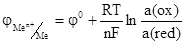 (2)
(2)
где n – число е- участвующих в окислительно-восстановительной реакции, F – число Фарадея, R – универсальная газовая постоянная, a(ax), а(red) – активности, соответственно, окисленной и восстановительной формы. Если рассматривать потенциал металла в растворе его собственной соли, то при Р = 101, 3 кПа и Т = 298 К активность чистого металла постоянна и принята равной единице, следовательно а(red) = a(Me) = 1. В этом случае выражение (2) упрощается:
|
|
|
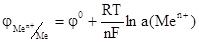 (3)
(3)
В разбавленном растворе вместо активностей можно подставить концентрации. Уравнение (2) носит название уравнения Нернста, которое характеризует электродный потенциал в условиях отличных от стандартных. В данном уравнении φ 0 – стандартный электродный потенциал. Стандартным электродным потенциалом считают потенциал, возникающий при погружении металлического электрода в раствор собственной соли при стандартных условиях (Т= 298, концентрация катионов металла – 1 моль · л-1) и измеренный относительно водородного электрода. Если в уравнении (2) подставить значения соответствующих констант R, T и F, то с учетом перехода от ln к lg получим:
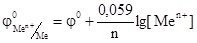
|
|
|


