 |
2.1. Измерение электродного потенциала
|
|
|
|
2. 1. Измерение электродного потенциала
Измерить абсолютное значение электродного потенциала, возникающего на границе металл – раствор, невозможно, так как для подключения измерительного прибора необходим второй металлический электрод. В таком случае измеряют только относительную величину потенциала по отношению к электроду, принятому за стандарт. Согласно международному соглашению таким стандартным электродом является водородный электрод, потенциал которого принят равным нулю.
Водородный электрод состоит из платиновой пластины, покрытой тонким слоем платиной черни и опущенной в водный раствор серной кислоты с активной концентрацией а(Н+), равной 1 моль · л-1. Через этот раствор пропускается ток чистого водорода под давлением 101, 3 кПа, который омывает платиновую пластину. Избыток водорода удаляется через верхнюю трубку (рис. 2). Платина, как и многие другие металлы этой группы, способна насыщаться водородом, в результате чего вся поверхность платиновой пластинки оказывается покрытой слоем водорода. В результате адсорбции на платине в газовой форме уста вливается равновесие
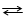 Н2 2Н
Н2 2Н
Таким образом, водородный электрод, подобно металлическому, представляет собой восстановительную форму Н0, погруженную в раствор, содержащий окисленную форму Н+.
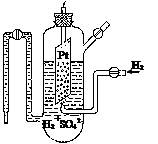 |
Рис. 2. Строение водородного электрода
Между поверхностным слоем водорода на платине и раствором устанавливается равновесие
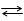 Н+ + е- Н
Н+ + е- Н
и возникает разность потенциалов, которая, как указано выше, принята равной нулю.
Для измерения величины стандартного электродного потенциала металлического электрода, данный электрод соединяют с водородным электродом проводником первого рода. При замыкании электрической цепи вследствие разности электродных потенциалов начнется движение электронов от электрода с меньшим потенциалом (обладающие избытком электронов) к электроду с большим потенциалом (обладающим меньшим количеством электронов). Так, если в качестве измеряемого электрода выступает цинк, то движение электронов будет направлено от цинка к платине. Уменьшение электронов на цинковой пластине будет смещать равновесие в сторону выхода катионов цинка в раствор, а следовательно на цинковом электроде будет протекать процесс окисления.
|
|
|
Zn0 → Zn2+ + 2e
На водородном электроде катионы Н+ принимают электроны и восстанавливаются.
2Н+ + е → Н2
Принято считать электрод, на котором протекает процесс окисления – анодом, а на котором процесс восстановления – катодом.
Зная величину ЭДС, измеренную в такой системе, можно легко вычислить потенциал электрода (метод измерения ЭДС разобран в разделе 3).
Так как в рассматриваемом процессе катодом является водородный электрод, а 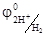 = 0
= 0
- φ А = ЭДС
Если потенциал измеряемого электрода больше водородного, то движение электронов будет направлено от платины к металлу и величина потенциала электрода будет положительной.
2. 2. Электрохимический ряд напряжений металлов
Если расположить все металлы по возрастанию величины стандартного электродного потенциала, получают ряд напряжений металлов, который представляет собой электрохимическую характеристику металлов. В этом ряду, чем ниже алгебраическая величина электродного потенциала, тем с большей легкостью данный металл отдает электроны (окисляется) и тем самым проявляет более высокую восстановительную способность. Например, Ca( 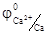 =-2, 8 В) является лучшим восстановителем, чем железо (
=-2, 8 В) является лучшим восстановителем, чем железо ( 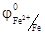 - 0, 44 В). Чем больше алгебраическая величина электродного потенциала, тем тяжелее данный металл отдает электроны, а катион, соответствующий данному металлу, является более активным акцептором электронов. Например, катион Cu2+ более сильный окислитель, чем Zn2+, а тем более Cu2+. Таким образом, в электрохимическом ряду напряжений с возрастанием величины стандартного электродного потенциала металлов увеличивается окислительная способность катионов, соответствующих этим металлам, восстановительная же способность атомов металлов в этом ряду уменьшается. С уменьшением стандартного электродного потенциала наблюдается зависимость, противоположная, рассмотренной выше.
- 0, 44 В). Чем больше алгебраическая величина электродного потенциала, тем тяжелее данный металл отдает электроны, а катион, соответствующий данному металлу, является более активным акцептором электронов. Например, катион Cu2+ более сильный окислитель, чем Zn2+, а тем более Cu2+. Таким образом, в электрохимическом ряду напряжений с возрастанием величины стандартного электродного потенциала металлов увеличивается окислительная способность катионов, соответствующих этим металлам, восстановительная же способность атомов металлов в этом ряду уменьшается. С уменьшением стандартного электродного потенциала наблюдается зависимость, противоположная, рассмотренной выше.
|
|
|
Таблица 1
Электрохимический ряд напряжений металлов
| Электрод | , В | Электрод | , В |
| Li+/Li | -3, 045 | Cd2+/Cd | -0, 403 |
| Rb+/Rb | -2, 925 | Co2+/Co | -0, 277 |
| K+/K | -2, 924 | Ni2+/Ni | -0, 25 |
| Cs+/Cs | -2, 923 | Sn2+/Sn | -0, 136 |
| Ba2+/Ba | -2, 90 | Pb2+/Pb | -0, 127 |
| Ca2+/Ca | -2, 87 | Fe3+/Fe | -0, 037 |
| Na+/Na | -2, 714 | 2H+/H2 | -0, 000 |
| Mg2+/Mg | -2, 37 | Sb3+/Sb | +0, 20 |
| Al3+/Al | -1, 70 | Bi3+/Bi | +0, 215 |
| Ti2+/Ti | -1, 607 | Cu2+/Cu | +0, 34 |
| Zr4+/Zr | -1, 58 | Cu+/Cu | +0, 52 |
| Mn2+/Mn | -1, 18 | Hg22+/Hg | +0, 79 |
| V2+/V | -1, 18 | Ag+/Ag | +0, 80 |
| Cr2+/Cr | -0, 913 | Hg2+/Hg | +0, 85 |
| Zn2+/Zn | -0, 763 | Pt2+/Pt | +1, 19 |
| Cr3+/Cr | -0, 74 | Au3+/Au | +1, 50 |
| Fe2+/Fe | -0, 44 | Au+/Au | +1, 70 |
Все металлы, расположенные в электрохимическом ряду напряжений до водорода, имеют более отрицательный потенциал, чем у водорода, а следовательно, в стандартных условиях могут быть окислены Н+. По этой причине эти металлы могут вытеснять водород из растворов разбавленных сильных минеральных кислот. Металлы, расположенные после водорода, не вытесняют водород из растворов разбавленных кислот.
Потенциал водородного электрода зависит от концентрации катионов Н+ в растворе
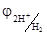 = 0, 059lg[H+]
= 0, 059lg[H+]
Так как величина lg[H+] = -рН
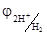 = - 0, 059рН
= - 0, 059рН
Из этого следует, что металлы, имеющие более отрицательный потенциал, чем –0, 413 В, могут восстанавливать водород из воды. К ним относятся металлы, включая кадмий. Однако на практике не все металлы, расположенные до кадмия, вытесняют водород из воды, а металлы, расположенные до водорода – водород из растворов кислот. Это происходит потому, что при окислении некоторых металлов на их поверхности образуются нерастворимые пленки, препятствующие дальнейшему взаимодействию. Примером этому может служить пассивирование свинца в серной кислоте из-за нерастворимости соли PbSO4. Металлы в ряду электрохимического напряжения до магния взаимодействуют с водой, магний вытесняет водород из горячей воды, а все последующие металлы, включая кадмий, образуют на поверхности нерастворимые гидроксиды и не взаимодействуют с водой.
|
|
|
Таким образом, электрохимический ряд напряжений металлов нужно использовать с учетом особенностей данного химического процесса.
|
|
|


