 |
Эта реакция протекает в организме при участии ферментов оксидоредуктаз
|
|
|
|
Билет 51
Гетероциклические ароматические соединения. В ряду этих соединений встречаются оба вида сопряжения. Пи-пи-сопряжение характерно для шестичленных гетероциклов с одним или несколькими гетероатомами. Простейшим их представителем является пиридин, содержащий в цикле один атом азота. Атом азота находится в состоянии sp2-гибридизации (две из трех sp2-гибридных орбиталей образуют сигма-связи). Он поставляет в ароматический секстет один р-электрон. Неподеленная пара электронов на sр2-гибридной орбитали обусловливает свойства пиридина как основания. Атом азота с таким электронным строением принято называть пиридиновым. В результате большей электроотрицательности по сравнению с атомом углерода пиридиновый атом азота понижает электронную плотность на атомах углерода ароматического кольца. Поэтому системы с пиридиновым атомом азота называют пи-недостаточными. Кроме пиридина, примером таких систем служит пиримидин, содержащий два пиридиновых атома азота. р-пи-сопряжение осуществляется в пятичленных гетероциклах с атомами азота, кислорода, серы. Довольно часто в составе биологически значимых соединений встречается гетероцикл с одним атомом азота — пиррол. В пирроле от атома азота в ароматический секстет включается находящаяся на негибридизованной р-орбитали пара электронов, три электрона на sp2-гибридных орбиталях участвуют в образовании трех сигма-связей. Атом азота втаком электронном состоянии получил название пиррольного. Шестиэлектронное облако в пирроле делокализовано на пяти атомах цикла, поэтому пиррол представляет собой пи-избыточную систему. В фуране и тиофене ароматический секстет также включает неподеленную пару электронов негибридизованной р-АО кислорода и серы соответственно, в имидазоле два атома азота вносят разный вклад в образование делокализованного электронного облака: пиррольный атом азота поставляет пару n-электронов, а пиридиновый — один р-электрон. В пиррольном и пиридиновом атомах азота электроны находятся на негибридизованных р-АО. Ароматическим характером обладает также пурин, представляющий собой конденсированную систему из двух гетероциклов — пиримидина и имидазола. Делокализованное электронное облако в пурине включает 10 пи-электронов.
|
|
|




Химические свойства пиррола
• 1)В связи с тем, что n – электроны атома азота втянуты в общий цикл, пиррол обладает очень слабыми основными свойствами. Наоборот, при взаимодействии с Na или К дает соли, проявляя кислотные свойства
2) при обработке пиррола кислотой атакующий протон кислоты локализует пару электронов сектета на атоме азота.
 3) способность пятичленных гетероциклов вступать в реакции электрофильного замещения так велика, что их называют суперароматическими соединениями.
3) способность пятичленных гетероциклов вступать в реакции электрофильного замещения так велика, что их называют суперароматическими соединениями.

 |
Химические свойства пиридина
1Пиридин — более слабое основание
2. Ароматические свойства. Подобно бензолу, пиридин вступает в реакции электрофильного замещения, однако его активность в этих реакциях ниже, чем бензола, из-за большой электроотрицательности атома азота. Пиридин нитруется при 300 °С с низким выходом:
 3 При гидрировании пиридина образуется пиперидин, который представляет собой циклический вторичный амин и является гораздо более сильным основанием, чем пиридин
3 При гидрировании пиридина образуется пиперидин, который представляет собой циклический вторичный амин и является гораздо более сильным основанием, чем пиридин
4 Гомологи пиридина по свойствам похожи на гомологи бензола. Так, при окислении боковых цепей образуются соответствующие карбоновые кислоты:

Вопрос 2
Простые эфиры-производные спиртов или фенолов, в которых атом водорода гидроксильной группы замещён на углеводородный радикал.
|
|
|
1не смешиваются с водой 2хорошо растворяют многие органические вещества
Слабые нейтральные nоснования. Растворяются в конц. Минеральных кислотах за счёт образования оксониевых солей, гидролизующихся избытком воды.
Диэтиловый эфир+H2SO4=гидросульфат диэтилоксония [(C2H5)2—O+ --H]HSO4—
Гидросульфат диэтилоксония+H2O=H3O+ +H2SO4- +C2H5OC2H5
Малореакционные вещества, инертные к щелочам, большинству кислот и других реагентов
В обычных условиях не гидролизуются
Расщепление эфирной связи лишь в жёстких условиях
Метилфениловый эфир+HBr->метилбромид+фенол
Сложные эфиры-это вещества, которые образуются в результате взаимодействия органических или кислородсодержащих неорганических кислот со спиртами(р-ции этерификации)
Уксусная кислота+этанол= Н+ уксусноэтиловый эфир(этилацетат) +H2O
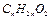 | |||
 | |||
Общая формула OR1 изомерны карбоновым кислоотам
Гидролиз – важнейшее химическое свойство сложных эфиров:
 Метилбутират H2+ T
Метилбутират H2+ T
2 метилпропановая
Многоатомные спирты, как и одноатомные взаимодействуют с органическими и неорганическими кислотами с образованием сложных эфиров
Н2С—ОН Н2С—О—COCH3
HC----OH +3CH3COOHà HC----O---COCH3 +3H2O триацетат глицерина (глицерилтриацетат)
H2C---OH H2C---O---COCH3
Н2С—ОН H2C—NO2
HC----OH +3HONO2 àH2SO4 конц. HC---NO2 +3H2O тринитрат глицерина(тринитроглицерин)
H2C---OH H2C—NO2
Сложные эфиры глицерина и высших карбоновых кислот представляют собой жиры
Эфир глицерина и пальмитиновой кислоты(трипальмиат глицурина, трипальмитин)
Эфир глицерина и олеиновой кислоты (триолеат глицерина, триолеин)
Эфир глицерина, олеиновой и стеариновой кислот(олеодистеорат глицерина, олеодистеарин)
Эфир глицерина и пальмитиновой,олеиновой и линолевой кислот(пальмитоолеолинолеин)
Вопрос 3
 Реакция с нингидрином, реакция на α-аминокислоты (используется для
Реакция с нингидрином, реакция на α-аминокислоты (используется для
визуального распознавания α-аминокислот)




восстрановленная форма нингидрида
Реакция с 2.4-динитрофторбензолом (ДНФБ)
– используется для отщепления N-концевой аминокислоты (щелочная среда):
образуется комплекс желтого цвета.

 динитрофторбензольное производное α аланина
динитрофторбензольное производное α аланина
Реакция с азотистой кислотой используется для количественного определения NH2 групп по объему выделившегося N2
|
|
|
 молочная кислота
молочная кислота
Реакция карбоксилирования –NH2 приводит к получению двухосновной аминокислоты.
 карбокси альфааланин
карбокси альфааланин
Практическое значение имеет реакция формольного титрования, используемая для количественного определения α-аминокислот.

Реакции дезаминирования (удаление NH2 группы в виде аммиака)
 окислительноеà
окислительноеà 
Гидролитическоеà  молочная кислота
молочная кислота
OH
Внутримолекулярноеà  акриловая кислота
акриловая кислота
Восстановительноеà  пропионовая кислота
пропионовая кислота
 +2H
+2H
Реакции за счет радикалов используются для идентификации отдельных аминокислот
Окислительно-восстановительное взаимопревращение цистеина
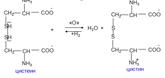
Эта реакция протекает в организме при участии ферментов оксидоредуктаз
Специфические свойства структурных изомеров аминокислот используются для их идентификации
γ, δ – аминокислоты образуют при нагревании циклические амиды - лактамы

В аминокислоты превращаются в непредельные карбоновые кислоты
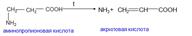
α аминокислоты выделяя 2 моль воды образуют циклические ангидриды, называемые дикетопиперазинами.
Вопрос 4
4. Осуществите превращения: бензол → нитробензол → анилин → сульфаниловая кислота → амид сульфаниловой кислоты.
1C6H6 + HNO3 (конц. H2SO4)----> C6H5NO2 + H2O
2C6H5NO2 + 3Н2 → C6H5NH2 + 2Н2О
 3C6H5NH2+ H2SO4→ HO3S C6H4 NH2+ H2O
3C6H5NH2+ H2SO4→ HO3S C6H4 NH2+ H2O
БИЛЕТ № 52
Вопрос 1
Индуктивный эффект – перераспределение электронной плотности по системе σ–связей, вызванное разной электроотрицательностью (ЭО) атомов.
+I эфф. имеют все R, причем для них I эфф. меняется в следующей последовательности: CH3 < C2H5 < (CH3)2 CH < (CH3)3C;
также +I эфф. характерен для Мe и иона О2-.
Графически и. э. обозначается стрелками(по направлению гамма связей) в направлении смещения электронов
Если атом или группа втомов оттягивает от атомв углеродаэлектронную пару гамма связи(как в бромметане) то на этом атоме образуется частичный отрицательный заряд(δ-) а на атоме углерода частичный δ+, при чём они равны по величине.
|
|
|
Если атом или группа атомов смещают к атому углеродаэлектронную пару намма связи,то на этом атоме образуется частичный положительный заряд,а на атоме углерода частичный отрицательный(они равны по величине).
В1 хлорпропане более электроотрицательный атом хлора оттягивает электронную пару связи С-С на себя,это смещение вызывает ментшее смещение электронной пары связи С-С между первым и вторым атомами углерода.При этом на каждом атоме углерода образуется уменьшающийся по мере удаление от атома хлора частичный положительный заряд, т е индуктивный эффект передаётся по гамма-связям, но с быстрым затуханием.Такое смещение электронной пары, вызываемое влиянием другой молекулы через пространство между ними,называется эффектом поля.Смещение электронов обычно рассматривается относительно стандарта, которым является водород(I=0)Направление и величина и. э.зависят от электроотрицательности,а знак эффекта совпадает с зарядом, приобретаемым заместителем при сдвиге электронов. Заместитель, который оттягивает от атома углерода электронную плотность проявляет отрицательный индуктивный эффект, а который смещает в сторону атома углерода электонную плотность проявляет положительный индуктивный эффект
Для определения знака и величины и. э. следующие правила:
1Величина отрицательного иэ растёт с увеличением заряда заместителя
2 алкильные группы проявляют тем более положительный иэ, чем сильнее их разветвлённость
3 чем больше электроотрицательность, тем сильнее отрицательный индуктивный эффект
4 у заместителей с кратными связями и ароматических -I тем больше, чем большекратность и ароматичность
5 влияние нескольких заместителей суммируется, но не равно
6 с удалением заместителя от реакционного центра его влияние падает, на четвёртый атом почти не влияет
7группы с полным положительным зарядом на атоме, связанном с атомом углерода, проявляют –I:R2S+ R2O+ R3N+
8 группы с полным отрицательным зарядом на атоме, проявляют +I: -O- =N
Мезомерный эффект (М) – перераспределение электронной плотности по системе p–связей.
М эфф., в отличие от I эфф., возникает лишь там, где появляется сопряжение.
|
|
|


