 |
ГЛИКОГЕН Напомним, что этот гомополисахарид - депо глюкозы, представленное, главным образом, в печени и мышцах.
|
|
|
|
При этом молекула гликогена менее растворима, чем глюкоза, поэтому не влияет на осмотическое давление в клетке; сберегается компактно в виде гранул в цитозоле; разветвленная структура с большим количеством концевых мономеров оптимизирует эффективность работы ферментов как при его синтезе, так и при распаде
Гликоген-структурный и функциональный аналогкрахмала(амилопектина). Основным отличием является гораздо большее разветвление цепей(через каждые 6-12 звеньев) и в десятки раз большая, чем у амилопектина молекулярная масса(100 млн(Огромная макромолекула гликогена, лишенная возможности проникать через клеточную мембрану, депонирована в клетке(у млекопитающихся в основном в клетках печени) и в стрессовых ситуациях выполняет энергетическую функцию,обеспечивая быстрое отщепления нужного количества глюкозы по имеющимся в ней многочисленным разветвлениям.
Фрагмент макромолекулы гликогена аналогичен фрагменту макромолекулы крахмала
Функции гликогена в печени – регуляция уровня глюкозы в крови в абсорбтивный и постабсорбтивный период; в мышцах – резерв глюкозы – источника энергии при мышечном сокращении..
Т.к.функции гликогена в печени и мышцах отличаются, то имеются и отличия как на этапе синтеза, так и распада гликогена в этих тканях
Вопрос 4
4. Напишите уравнения реакций взаимодействия кротонового альдегида с: а) бромом; б) водным раствором КMnO4; В) СН3ОН; Г) NH3; Д) NaHSO3.
Билет 54
Вопрос 1
Для ароматических соединений бензольного ряда, конденсированных и гетероциклических ароматических соединений характерны реакции, не приводящие к нарушению ароматической состемы, то есть реакции замещения.
|
|
|
Наличие пи электронного сопряжённого облака обуславливает повышенную электронную плотность ароматического цикла и в связи с этим склонность подвергаться атаке электрофильным реагентом.
Таким образом характерными реакциями ароматических соединений являются реакции электрофильного замещения (Se)
Любая частица, способная взаимодействовать с электронной парой, называется электрофильной.
Правила ориентации при электрофильном замещении в бензольном кольце основаны на взаимном влиянии атомов в молекуле. Если в незамещенном бензоле С6Н6 электронная плотность в кольце распределена равномерно, то в замещенном бензоле С6Н5Х под влиянием заместителя Х происходит перераспределение электронов и возникают области повышенной и пониженной электронной плотности. Это оказывает влияние на легкость и направление реакций электрофильного замещения. Место вступления нового заместителя определяется природой уже имеющегося заместителя.
 Правила ориентации
Правила ориентации
3. Заместители, имеющиеся в бензольном ядре, направляют вновь вступающую группу в определенные положения, т.е. оказывают ориентирующее действие.
4. По своему направляющему действию все заместители делятся на две группы: ориентанты первого рода и ориентанты второго рода.
Ориентанты 1-го рода (орто-пара -ориентанты) направляют последующее замещение преимущественно в орто - и пара -положения.
К ним относятся электронодонорные группы (электронные эффекты групп указаны в скобках):
-R (+I); - OH (+M,-I); - OR (+M,-I); - NH2 (+M,-I); - NR2 (+M,-I)
+M-эффект в этих группах сильнее, чем -I-эффект.
Ориентанты 1-го рода повышают электронную плотность в бензольном кольце, особенно на углеродных атомах в орто - и пара -положениях, что благоприятствует взаимодействию с электрофильными реагентами именно этих атомов.
Ориентанты 1-го рода, повышая электронную плотность в бензольном кольце, увеличивают его активность в реакциях электрофильного замещения по сравнению с незамещенным бензолом.
|
|
|
Особое место среди ориентантов 1-го рода занимают галогены, проявляющие электроноакцепторные свойства: - F (+M<–I), - Cl (+M<–I), - Br (+M<–I).
Являясь орто-пара -ориентантами, они замедляют электрофильное замещение. Причина - сильный –I -эффект электроотрицательных атомов галогенов, понижащий электронную плотность в кольце.
 Ориентанты 2-го рода (мета -ориентанты) направляют последующее замещение преимущественно в мета -положение.
Ориентанты 2-го рода (мета -ориентанты) направляют последующее замещение преимущественно в мета -положение.
К ним относятся электроноакцепторные группы:
- NO2 (–M, –I); - COOH (–M, –I); - CH=O (–M, –I); - SO3H (–I); - NH3+ (–I); - CCl3 (–I).
Ориентанты 2-го рода уменьшают электронную плотность в бензольном кольце, особенно в орто - и пара -положениях. Поэтому электрофил атакует атомы углерода не в этих положениях, а в мета -положении, где электронная плотность несколько выше.
Пример:
Все ориентанты 2-го рода, уменьшая в целом электронную плотность в бензольном кольце, снижают его активность в реакциях электрофильного замещения.
Таким образом, легкость электрофильного замещения для соединений (приведенных в качестве примеров) уменьшается в ряду:
толуол C6H5CH3 > бензол C6H6 > нитробензол C6H5NO2.
Вопрос 2
Салициловая кислота(о-гидроксибензойная) оказывает антиревматическое, жаропонижающее и антигрибковое действие но, как сильная кислота, вызывает раздражение пищеварительного тракта и по этому применяется только наружно
Получают салициловую кислоту приямым карбоксилированием фенола или фенолята натрия(р я Кольбе). Реакция прямого карбоксилирования фенола возможна благодаря активирующему действию гидроксильной группы:
Салициловая кислота сильная, что связано с образованием внутримолекулярной водородной связи, которая способствует стабилизации карбоксилат-аниона и приводит к возрастанию кислотности
Салициловая кислота способна образовывать производные по каждой функциональной группе. Производные салициловой кислоты оказывают анальгетическое, жаропонижающее и противовоспалительное действие Наибольшее значение имеет п аминосалициловая кислота(паск) как противотуберкулёзное средство
Реакция с хлоридом железа (III). От прибавления раствора хлорида железа (III) к салициловой кислоте жидкость приобретает сине-фиолетовую окраску. Состав и окраска комплексов, образующихся при взаимодействии салициловой кислоты с ионами железа, зависит от рН среды. При рН=1,8...2,5 образуется моносалицилатный комплекс (I), имеющий сине-фиолетовую окраску. При рН = 4...8 образуется дисалицилатный комплекс (II), имеющий красно-бурую окраску. Трисалицилатный комплекс железа (III), имеющий желтую окраску, образуется при рН = 8...11:
|
|
|

Реакция образования метилсалицилата. При нагревании салициловой кислоты с метиловым спиртом в присутствии серной кислоты образуется метиловый эфир салициловой кислоты (метилсалицилат):

Предварительные пробы на наличие салициловой кислоты в моче и крови. Для обнаружения салициловой кислоты в моче и крови предложены предварительные пробы, основанные на реакции с реактивом Триндлера и на реакции с нитратом железа (III).
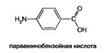
Парааминобензойнаякислота - Фактор роста многих микроорганизмов (витамин Н1); вместе с фолиевой кислотой участвует в процессах биосинтеза пуринов и пиримидинов.
ПАБК плохо растворяется в воде, хорошо — в спирте и эфире; химически устойчива.
Участие в метаболизме. Витаминные свойства ПАБК связаны с тем, что она входит в состав молекулы фолиевои кислоты, следовательно, ПАБК принимает участие во всех реакциях метаболизма, где необходим витамин Вс.
Вопрос 3
Полисахариды – сложные высокомолекулярные соединения, макромолекулы которых состоят из большого числа остатков моносахаридов.
Полимеры, состоящие из остатков моносахаридов одного вида, называются гомополисахаридами. К ним относятся крахмал, гликоген, клетчатка (целлюлоза).
Структурным звеном крахмала является a-глюкоза. В макромолекуле крахмала остатки а-глюкозы связаны между собой 1-4 и 1-6 гликозидными связями.
Полисахариды, построенные из остатков только одного моносахарида, наз. гомополисахаридами (гомогликанами); в соответствии с природой этого моносахарида различают глю-каны, маннаны, галактаны, ксиланы, арабинаны и др. Полное название полисахарида должно содержать информацию об абс. конфигурации входящих в его состав моносахаридных остатков, размере циклов, положении связей и конфигурации гликозидных центров; в соответствии с этими требованиями строгим назв., напр., целлюлозы будет поли(1: 4)-b-D-глюкопиранан.
|
|
|
|
|
|


