 |
Термодинамические свойства газов.
|
|
|
|
В отличие от капельных жидкостей газы способны значительно изменять свой объем при изменении давления и температуры, поэтому многие положения гидравлики нельзя механически переложить на аэродинамику. Хотя такое различие и существует, законы движения и равновесия капельных жидкостей и газов при определенных условиях можно считать одинаковыми. Главным таким условием является малое значение скорости движения газа по сравнению со скоростью звука в нем, когда сжимаемость газа можно не учитывать и считать плотность газа постоянной. В связи с этим законы движения капельных жидкостей можно принять для газов лишь при скоростях движения, не превышающих 100 м/с (при этом плотность газов изменяется не более чем на 3%).
В системах вентиляции и кондиционирования воздуха скорости его движения небольшие, поэтому для таких систем остаются в силе основные законы и положения, изложенные в основном курсе гидравлики.
Принятые в гидравлике основные определения напоров, давлений, скоростей, расхода, сопротивлений по длине и местных и других параметров потока в равной степени применимы и для аэродинамики. Имея в виду, что многие законы аэродинамики основываются на положениях термодинамики, рассмотрим кратко термодинамические свойства газов.
Термодинамическое состояние газа характеризуется давлением  , плотностью
, плотностью  и температурой
и температурой  . Зависимость между этими параметрами с достаточной степенью точности можно выразить уравнением состояния идеального газа:
. Зависимость между этими параметрами с достаточной степенью точности можно выразить уравнением состояния идеального газа:
 , (6.1)
, (6.1)
где  - удельная газовая постоянная, различная для разных газов, но не зависящая от температуры и давления; для воздуха
- удельная газовая постоянная, различная для разных газов, но не зависящая от температуры и давления; для воздуха  .
.
Как следует из кинетической теории газов, температура и давление газа определяются средней кинетической энергией теплового движения молекул. Представим два равных объема разных газов при одинаковых температуре и давлении, тогда из равенства температур вытекает равенство средних кинетических энергий поступательного движения, приходящихся на одну молекулу каждого газа, а из равенства давлений- равенство суммарных кинетических энергий молекул в каждом объеме газов. Отсюда следует закон Авогадро- в равных объемах различных идеальных газов при одинаковых температуре и давлении содержится одинаковое число молекул. Поскольку массы молекул разных газов пропорциональны их относительным молекулярным массам, то из закона Авогадро следует, что количество газов, пропорциональное их относительным молекулярным массам, должно содержать одно и то же число молекул и занимать при одинаковых давлении и температуре один и тот же объем.
|
|
|
Количество газа в килограммах, численно равное его молярной массе, называется киломолем. При нормальных условиях, т.е. при температуре  и давлении
и давлении  , объем 1 киломоля газа равен
, объем 1 киломоля газа равен  .
.
Произведение молярной массы на удельную газовую постоянную  является одинаковыми для всех газов, поэтому величина
является одинаковыми для всех газов, поэтому величина  называется универсальной газовой постоянной.
называется универсальной газовой постоянной.
Следовательно, для любого газа удельную газовую постоянную  ,
,  , и плотность
, и плотность 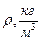 можно определить из формул:
можно определить из формул:
 (6.2)
(6.2)
 (6.3)
(6.3)
Изменение состояния газа (изменение его объема, давления или температуры) может произойти при тепловом или механическом либо при совместном тепловом и механическом воздействии. Тепловое воздействие осуществляется сообщением теплоты газу или отведением её от газа, механическое - в совершении газом некоторой работы или в приложении к нему некоторой энергии, например при сжатии газа.
Известно, что количество теплоты Q, Дж, численно равно этой работе А, Дж.
Равенство теплоты и работы является результатом более общего первого закона термодинамики, согласно которому теплота ΔQ, сообщаемая покоящемуся газу, передается частично на повышение его температуры, т.е. на увеличение внутренней энергии газа ΔU и частично на совершение внешней работы А.
|
|
|
ΔQ=ΔU+A (6.4)
Если газ будет двигаться, то часть теплоты затрачивается на изменение кинетической энергии, и тогда уравнение баланса энергии будет иметь вид:
 (6.5)
(6.5)
где  - изменение кинетической энергии газа.
- изменение кинетической энергии газа.
Если масса газа, заключенная в объеме W равна единице, то плотность газа  и уравнение состояния можно записать так:
и уравнение состояния можно записать так:
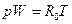 (6.6)
(6.6)
Это условие устанавливает связь между тремя основными параметрами р, W и Т, характеризующими данную массу газа. Таким образом, из трех параметров любые два могут рассматриваться как независимые, а третий может быть выражен с помощью этого уравнения через них.
При всем многообразии процессов перехода газа из одного состояния в другое все эти процессы могут быть разделены на наиболее характерные; рассмотрим их.
Изотермический процесс. Изотермический процесс протекает при постоянной температуре газа (T=const). Из уравнения (6.6) следует, что при этом
PW=const (6.7)
Уравнение процесса будет иметь вид:
 (6.8)
(6.8)
(закон Бойля- Мариотта). Так как внутренняя энергия идеального газа зависит только от температуры, то при изотермическом расширении ΔU=0, и вся теплота, сообщенная газу, превращается в работу, т.е.
ΔQ=A
Работа при изотермическом процессе:
 (6.9)
(6.9)
Изохорный процесс. Изохорным называется процесс, при котором объем газа остается постоянным (W=const), а меняется лишь его давление р и температура Т. Этот процесс осуществляется при нагревании газа в замкнутом сосуде. Так как W=const, то А=0, т.е. при изохорном процессе газ не совершает механической работы. Для этого случая:
 (6.10)
(6.10)
При изменении температуры на ΔТ изменение внутренней энергии единицы массы газа можно представить в виде:
 (6.11)
(6.11)
где 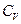 - удельная теплоемкость газа при постоянном объеме.
- удельная теплоемкость газа при постоянном объеме.
Изобарический процесс. Изобарическим называется процесс, протекающий при постоянном давлении (p=const). Уравнение процесса:
 (6.12)
(6.12)
(закон Гей-Люссака). Работа при изобарическом расширении:
 (6.13)
(6.13)
Адиабатический процесс. Если сосуд с газом изолировать (в смысле обмена теплоты) от окружающей среды, то теплообмен будет отсутствовать, т.е. ΔQ=0. Процесс, происходящий при соблюдении этого условия, называется адиабатическим.
|
|
|
При ΔQ=0 из (6.4) получим:
А=-ΔU
Отношение удельных теплоемкостей  называется показателем адиабаты. Для одноатомных газов к=1,67; для двухатомных газов при обычных температурах к=1,4.
называется показателем адиабаты. Для одноатомных газов к=1,67; для двухатомных газов при обычных температурах к=1,4.
Уравнение адиабатического процесса:
 (6.14)
(6.14)
или
 . (6.15)
. (6.15)
Из (6.15) следует зависимость для отношения температур при адиабатическом процессе

или
 .
.
Политропический процесс. Процесс, при котором все или некоторые параметры переменны, называется политропическим. Уравнение политропы имеет вид:
 ,
,
где n - показатель политропы, величина переменная.
Рассмотренные ранее термодинамические процессы являются частными случаями политропического процесса. Например, для адиабатического процесса показатель политропы n равен показателю адиабаты к, для изотермического процесса n=1, для изобарического процесса n=0, для изохорического процесса n=∞.
|
|
|


