 |
Первая помощь при несчастных случаях
|
|
|
|
1. При ранении стеклом удалите осколки из раны, смажьте края раны раствором йода и перевяжите бинтом. При попадании на руки или лицо реактив, смойте реактив большим количеством воды.
2. При термическом ожоге смажьте обожженное место мазью от ожога. При химических ожогах глаз, обильно промойте глаза водой, а затем сразу обратитесь к врачу.
Лабораторная работа № 1
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Цель работы: рассмотрение реакций комплексообразования, строение комплексов, определение устойчивости комплексов.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Соединения сложного состава, в которых можно выделить центральный атом и непосредственно связанные с ним молекулы или ионы называются комплексными или координационными соединениями. Существование комплексных соединений было установлено Альфредом Вернером, награжденным в 1913 году Нобелевской премией за разработку химии координационных соединений.
Строение комплексных соединений.
K3+[Fe3+(CN)6−] [Co3+(NH3)60]Cl3−
лиганды лиганды
комплексообразователь комплексообразователь
Fe3+, Co3+ - комплексообразователь, всегда пишется на первом месте после квадратных скобок. Комплексообразователем, как правило, являются металлы и чаще всего d-элементы, но существует целый ряд комплексных соединений, где центральным атомом служит неметалл – Si, P, As.
CN−, NH30 – лиганды, молекулы или ионы, окружающие центральный атом, представлены нейтральными молекулами или анионами. Лигандами могут быть и сложные органические соединения.
[Fe3+(CN)6−]3−, [Co3+(NH3)60]3+ - комплексный ион или внутренняя сфера, в зависимости от степени окисления может быть комплексным катионом, комплексным анионом, электронейтральным комплексом.
|
|
|
K+, Cl− - ионы составляющие внешнею сферу.
Координационное число комплексообразователя – это число атомов лигандов, координированных вокруг центрального атома, обычно бывает четным числом (2,4,6,8). Координационное число центрального атома металлы не связано с его степенью окисления, но, как правило, превышает её.
В зависимости от числа донорных атомов лиганда, различают моно-, би- и полидентантные лиганды. Лиганды, координирующиеся через два или более донорных атомов к одному центральному атому, называются хелатными.
Комплексные соединения, в которых два или более комплексообразователя, называются би- или полиядерными комплексными соединениями – [Sn2(OH)2]2+, [Sn3(OH)4]2+, чаще всего данные комплексы образуются при гидролизе.
Таблица 1
Координационное число комплексообразователей
| Комплексообразователи | Характерное координационное число |
| Cu+, Ag+, Au+ | |
| Cu2+, Hg2+, Pb2+, Pt2+, Pd2+ Al3+, Zn2+ | |
| Ni2+, Ni3+, Co3+ | 4 или 6 |
| Fe2+, Fe3+, Pt4+, Pd4+, Si4+ Cr3+ |
Составление формул комплексных соединений
При составлении формулы внутренней сферы на первом месте после квадратных скобок пишется центральный атом, т.е. комплексообразователь. Затем лиганды с указанием их числа –n, если лиганды разные, то они записываются в следующем порядке – нейтральные лиганды с указанием их числа, потом анионы, также с указанием их числа.
Например:
[Co3+(NH3)50 Cl−]2+, [Pt4+(NH3)40Cl2−]2+
При составлении формулы комплексного соединения индексы следует расставить таким образом, чтобы сумма всех зарядов была равна нулю.
Например:
K22+[Pt4+(OH)6−]2−
Классификация комплексных соединений
В зависимости от заряда комплексного иона комплексные соединения делятся на катионные, анионные и нейтральные:
| катионные | анионные | нейтральные |
| [Cu(NH3)4]2+(OH)2− [Ni(H2O)4]2+Cl2− [Cr(H2O)5Cl]2+Cl2− | K2+[PtF6]2− K3+[Co(CN)6]3− Na2+[PdCl6]2− | [Ni(CO)4] [Pt(NH3)2Cl2] [Fe(NH3)4Cl2] |
Также комплексные соединения делятся на кислоты, основания и соли.
|
|
|
Номенклатура комплексных соединений
Образование названий анионных и катионных комплексов отличается. Название катионного комплекса начинают записывать с названия внешней сферы, затем одним словом пишется название комплексного катиона, начало которого составляет название лигандов с указанием их числа, обозначаемого префиксами – ди-, три-, тетра-, пента-, гекса-. Последним записывают комплексообразователь с указанием степени окисления римской цифрой.
Например:
[Cu(NH3)4](OH)2 − гидроксид тетраамминмеди(II)
[Cr(H2O)5Cl]Cl2 − хлорид хлоропентааквахрома(III)
[Co(NH3)4(NO2)Cl]NO3 − нитрат хлоронитротетраамминкобальта(III)
Образование названий анионных комплексов начинают с названия комплексного аниона в соответствии с теми же правилами, что и названия комплексного катиона, но с добавлением суффикса «ат» к названию комплексообразователя. Затем называют ионы внешней сферы.
Например:
K3[Co(CN)6] − гексацианокобальтат(III) калия
K[Pt(NH3)Cl3] − трихлороамминплатинат(II) калия
K[Au(CN)2] − дицианоаурат(I) калия
Образование названий нейтральных комплексов начинается с названия и числа лигандов, затем называется комплексообразователь и его степень окисления.
Например:
[Ni(CO)4] − тетракарбонилникеля
[Pt(NH3)2Cl2] − дихлородиамминплатины(II)
Таблица 2
Номенклатура лигандов
| лиганды | название |
| H2O NH3 CO NO CS OH− F− Cl− Br− I− CN− NCS− NO2− | аква- амин- карбонил- нитрозил- тиокарбонил- гидроксо- фторо- хлоро- бромо- йодо- циано- тиоциано- (родано-) нитро- |
Пространственное строение комплексных соединений
В пространстве комплексные ионы имеют форму многогранников (в соответствии с моделью Кеперта, атом металла лежит в центре многогранника, а лиганды располагаются в вершинах многогранника). Возможны следующие конфигурации:
- линейное расположение – комплексы с координационным числом 2 − [CuCl2]−, [Ag(CN)2]−.
- плоский равносторонний треугольник – комплексы с координационным числом 3 − [HgI3]−.
- тетраэдрическая конфигурация – комплексы с координационным числом 4 − [BF4]−.
- плоский квадрат – комплексы с координационным числом 4 − [Pt(NH3)2Cl2].
|
|
|
- тригонально-бипирамидальная конфигурация - комплексы с координационным числом 5 − [Fe(CO)5].
- октаэдрическая конфигурация − комплексы с координационным числом 6 − [PtCl6]2−.
Изомерия комплексных соединений.
Рассматривают два типа изомерии комплексных соединений. Первый тип изомеров – при котором состав внутренней сферы не изменяется, это может быть пространственная или оптическая изомерия.
Например:
Пространственные изомеры комплексного соединения [Pt(NH3)2Cl2] (по положению лигандов относительно комплексообразователя)


а б
Рис. 1 Пространственный комплекс: а – цис-изомер, б – транс-изомер
Второй тип комплексных изомеров – при котором меняется состав внутренней сферы – ионизационная, гидратная изомерия.
Например:
Гидратная изомерия комплексного соединения [Cr(H2O)6]Cl3:
[Cr(H2O)5Cl]Cl2 ∙ H2O, [Cr(H2O)4Cl2]Cl∙2H2O
Устойчивость комплексных соединений
В водном растворе диссоциация комплексных соединений протекает полностью на внешнию сферу и комплексный ион. Диссоциация комплексного иона протекает незначительно и характеризуется так называемой константой нестойкости.
[Fe(CN)6]4− ↔ Fe2+ + 6CN−

В таблице 3 представлена классификация комплексообразователей и их гидроксидов в зависимости от амфотерности и способности растворяться в щелочах, таблица 3.
Таблица 3
Характерные комплексы
| комплексообразователи | образование комплексных соединений |
| Zn2+, Al3+, Sn2+, Cr3+ | гидроксиды амфотерны растворяются в избытке щелочи |
| Сo2+, Ni2+, Cu2+, Cd2+, Hg2+ | гидроксиды растворяются в избытке аммиака |
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
! Для составления формул комплексных соединений воспользуйтесь таблицей 1.
Опыт 1. Получение гидроксокомплексных соединений.
а) В первую пробирку внесите 5-6 капель хлорида алюминия и по каплям прибавляйте раствор гидроксида калия, сначала до образования осадка и затем до его полного растворения.
- составьте уравнения реакций в молекулярном и ионном виде.
- напишите название полученного комплексного соединения.
- напишите выражение для константы нестойкости комплексного иона и выпишите из справочника его значение.
|
|
|
- запишите наблюдения.
б) Во вторую пробирку внесите 5-6 капель нитрата хрома и по каплям прибавляйте раствор гидроксида калия, сначала до образования осадка и затем до его полного растворения.
- составьте уравнения реакций в молекулярном и ионном виде.
- напишите название полученного комплексного соединения.
- напишите выражение для константы нестойкости комплексного иона и выпишите из справочника его значение.
- запишите наблюдения.
в) В третью пробирку внесите 5-6 капель хлорида цинка и по каплям прибавляйте раствор гидроксида калия, сначала до образования осадка и затем до его полного растворения.
- составьте уравнения реакций в молекулярном и ионном виде.
- напишите название полученного комплексного соединения.
- напишите выражение для константы нестойкости комплексного иона и выпишите из справочника его значение.
- запишите наблюдения.
Опыт 2. Получение аминокомплексных соединений
а) В первую пробирку внесите 5-6 капель сульфата меди и по каплям прибавляйте раствор гидроксида аммония, сначала до образования осадка и затем до его полного растворения.
- составьте уравнения реакций в молекулярном и ионном виде.
- напишите название полученного комплексного соединения.
- напишите выражение для константы нестойкости комплексного иона и выпишите из справочника его значение.
- запишите наблюдения.
б) Во вторую пробирку внесите 5-6 капель сульфата никеля и по каплям прибавляйте раствор гидроксида аммония, сначала до образования осадка и затем до его полного растворения.
- составьте уравнения реакций в молекулярном и ионном виде.
- напишите название полученного комплексного соединения.
- напишите выражение для константы нестойкости комплексного иона и выпишите из справочника его значение.
- запишите наблюдения.
Опыт 3. Получение роданокомплесных соединений
а) В первую пробирку внесите 5-6 капель хлорида железа(III) и по каплям прибавляйте раствор роданида калия до изменения окраски раствора.
- составьте уравнение реакции в молекулярном и ионном виде.
- напишите название полученного комплексного соединения.
- напишите выражение для константы нестойкости комплексного иона и выпишите из справочника его значение.
- запишите наблюдения.
! Повторите опыт с сульфатом железа (II). Внесите в пробирку сульфат железа на кончике шпателя и долейте 5 мл дистиллированной воды. Внесите в пробирку 1-2 капли роданида калия.
б) Во вторую пробирку внесите 5-6 капель нитрата хрома и по каплям прибавляйте раствор роданида калия до изменения окраски раствора.
|
|
|
- составьте уравнение реакции в молекулярном и ионном виде.
- напишите название полученного комплексного соединения.
- напишите выражение для константы нестойкости комплексного иона и выпишите из справочника его значение.
- запишите наблюдения.
в) В третью пробирку внесите 5-6 капель сульфата меди и по каплям прибавляйте раствор роданида калия до изменения окраски раствора.
- составьте уравнение реакции в молекулярном и ионном виде.
- напишите название полученного комплексного соединения.
- напишите выражение для константы нестойкости комплексного иона и выпишите из справочника его значение.
- запишите наблюдения.
Опыт 4. Реакции ионного обмена с участием комплексных соединений.
а) В первую пробирку внесите 5-6 капель хлорида железа (III) и по каплям прибавляйте раствор гексацианоферрата (II) калия.
- составьте уравнение реакции в молекулярном и ионном виде.
- напишите название полученного комплексного соединения.
- напишите выражение для константы нестойкости комплексного иона и выпишите из справочника его значение.
- запишите наблюдения.
б) В первую пробирку внесите на кончике шпателя сульфат железа (II) и по каплям прибавляйте раствор гексацианоферрата (III) калия.
- составьте уравнение реакции в молекулярном и ионном виде.
- напишите название полученного комплексного соединения.
- напишите выражение для константы нестойкости комплексного иона и выпишите из справочника его значение.
- запишите наблюдения.
в) В первую пробирку внесите 5-6 сульфата меди и по каплям прибавляйте раствор гексацианоферрата (II) калия.
- составьте уравнение реакции в молекулярном и ионном виде.
- напишите название полученного комплексного соединения.
- напишите выражение для константы нестойкости комплексного иона и выпишите из справочника его значение.
- запишите наблюдения.
г) В первую пробирку внесите 5-6 капель сульфата никеля и по каплям прибавляйте раствор гексацианоферрата (II) калия.
- составьте уравнение реакции в молекулярном и ионном виде.
- напишите название полученного комплексного соединения.
- напишите выражение для константы нестойкости комплексного иона и выпишите из справочника его значение.
- запишите наблюдения.
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ
1. Какое выражение соответствует константе нестойкости комплексного иона в соединении Na3[Co(NO2)6]?
1) 
| 4) 
|
2) 
| 5) 
|
3) 
|
2. В каком соединении степень окисления комплексообразователя наименьшая?
| 1) [Cu(NH3)4]SO4 | 4) [Ag(NH3)2]Cl |
| 2) [Ni(NH3)6]Cl2 | 5) [Co(NH3)4]Cl2 |
| 3) [Hg(NH3)4](NO3)2 |
3. Чему равно координационное число комплексообразователя в соединении [Co(NH3)2(H2O)4]Cl3?
| 1) 9 | 2) 6 | 3) 2 | 4) 4 | 5) 7 |
4. Указать формулу гексацианоферрат (II) калия.
| 1) K3[Fe(CN)6] | 4) K2[Pt(CN)4] |
| 2) K4[Ni(CN)6] | 5) K4[Fe(CN)6] |
| 3) K3[Co(CN)6] |
5. Сравнив константы нестойкости, указать самый нестойкий ион.
1) 
| 4) 
|
2) 
| 5) 
|
3) 
|
Лабораторная работа № 2
ЗАМЕРЗАНИЕ РАСТВОРОВ
Цель работы: определить температуру замерзания растворителя (воды), 1-моляльного раствора KCl и 2,5-моляльного раствора KCl; вычислить степень диссоциации растворов хлорида калия и сравнить их между собой.
1. ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Термодинамика процесса растворения.
Растворение веществ происходит с различными тепловыми эффектами.
Тепловой эффект сольватации - количество теплоты, которая выделяется при взаимодействии растворенного вещества с молекулами растворителя и образование связей между ними. Тепловой эффект, сопровождающий процесс растворения, относящийся к 1 молю растворенного вещества, называется молярной теплотой растворения ΔНраств.
ΔНраств. = ∆Н1 + ∆Н2
где ∆Н1 - количество теплоты, затраченной на распределение частиц растворяемого вещества среди молекул растворителя; или для твердого вещества, энергия необходимая для разрушения кристаллической решетки и энергия необходимая для разрыва связей между молекулами растворителя (процесс эндотермический).
∆Н2 - тепловой эффект сольватации (процесс экзотермический).
Сольватация - электростатическое взаимодействие между частицами (ионами, молекулами) растворенного вещества и растворителя. Сольватация в водных растворах называется гидратацией.
В зависимоссти от того преобладает первая или вторая составляющие, процесс растворения может быть экзотермический или эндотермический:
если ∆Н2>∆Н1, процесс экзотермический и ∆Н < 0;
если ∆Н2 < ∆Н1, процесс эндотермический и ∆Н > 0.
Так, например, тепловой эффект  раств.(CuSO4) = 68,37 кДж/моль,
раств.(CuSO4) = 68,37 кДж/моль,
 раств.(Н2SO4) = 96.8 кДж/моль.
раств.(Н2SO4) = 96.8 кДж/моль.
Коллигативные свойства растворов.
Свойства растворов, которые зависят только от концентрации частиц в растворе и не зависят от природы растворенного вещества, называются коллигативными.
Коллигативные свойства разбавленных растворов могут быть описаны количественно и выражены в виде законов. К ним относятся:
- давление насыщенного пара растворителя над раствором (закон Рауля)
- температура кристаллизации раствора
- температура кипения раствора
- осмотическое давление
1 закон Рауля: относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества.

где: p0 - давление насыщенного пара над растворителем,
p - давление насыщенного пара над раствором,
n0 - число моль растворителя,
n - число моль растворенного вещества,
2 закон Рауля: понижение температуры кипения и повышение температуры замерзания раствора прямо пропорционально моляльной концентрации раствора (число моль растворенного вещества в 1 кг растворителя):


где: Ккр. – криоскопическая константа, Кэб. – эбулиоскопическая константа, выбираются для растворителя,
mр. вещества – масса растворенного вещества, г.
Мр. вещества – молярная масса растворенного вещества. г\моль.
mрастворителя – масса растворителя.г.
Осмос. Осмотическое давление, закон Вант-Гоффа.
Осмос - односторонняя самопроизвольная диффузия молекул растворителя через полупроницаеую мембрану из раствора с низкой концентрацией в раствор с более высокой концентрацией.
Осмотическое давление росм. – внутреннее давление растворенного вещества, численно равное тому внешнему давлению, которое нужно приложить, чтобы прекратить явление осмоса:

где СМ – молярная концентрация раствора, моль/л
R = 8,31 кДж/моль·К, универсальная газовая постоянная
Т- температура, К.
Данные законы справедливы для идеальных растворов или растворов неэлектролитов, в растворах электролитов следует учесть диссоциацию молекул на ионы, т.к. для них не выполняются законы Рауля и Вант-Гоффа.
Для учета этих отклонений Вант-Гофф внес в уравнения поправку для растворов электролитов:
i – изотонический коэфициэнт.

Изотонический коэффициэнт, как поправку вводят в уравнения свойств растворов. Изотонический коэффициент для растворов электролитов всегда больше единицы, причем с разбавлением раствора i возрастает до некоторого целочисленного значения.
Степень диссоциации – отношение числа молекул, распавшихся на ионы, к общему числу молекул:

где: α – степень диссоциации
N – число молекул, распавшихся на ионы
N0 – общее число молекул

n – число ионов, на сколько диссоциирует молекула. Например для реакции:
CaCl2 → Ca2+ + 2Cl¯, n=2.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Задание выполняется на установке, которая представлена на рисунке 1.

Рис. 1. Схема установки для определения температуры замерзания:
1 - термометр; 2 - стакан с водой или раствором; 3 - охлаждающая смесь.
В кристаллизаторе 1 приготовьте охлаждающую смесь, состоящую из снега и поваренной соли: 3-5 чайных ложек соли на 5-8 ложек снега.
В стакан 3 налейте 5 -6 мл дистиллированной воды и поместите его в охлаждающую смесь.
Помешивая воду термометром (осторожно, чтобы не разбить термометр), определите температуру замерзания воды. Температурой замерзания считать ту, которую покажет термометр после появления первого кристаллика льда в замораживаемой жидкости.
Аналогично определите температуру замерзания 1-моляльного и 2,5 моляльного раствора хлорида калия. Результаты представьте в виде таблицы.
Таблица 1
| Система | tзам | Δtзам | Изотонический коэффициент i | Степень диссоциации α |
| H2O | - | - | - | |
| 1-моляльный раствор KCl | ||||
| 2,5-моляльный раствор KCl |
Рассчитайте изотонический коэффициент i. используя формулу
Δtзам = i ∙K∙Cm,
где Δtзам = tзам(р-ля) - tзам(р-ра)
K- криоскопическая константа растворителя, К(H2O)=1,86;
Cm- моляльность раствора,
По полученным данным рассчитайте степень диссоциации раствора KCl в воде по формуле α = 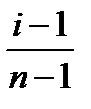 , где n – число ионов, на которые распадается данная молекула.
, где n – число ионов, на которые распадается данная молекула.
Постройте график зависимости температуры замерзания раствора от концентрации растворенной соли.
Сделайте выводы:
1) сравните температуру замерзания растворителя и растворов, сравните температуру замерзания двух растворов разной концентрации;
2) сравните степени диссоциации двух растворов разной концентрации.
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ
1. Вычислить понижение температуры замерзания раствора, если в 550 г бензола растворили 60 г гексана (C6H14), криоскопическая постоянная бензола - Ккр =5,07 К·кг/моль.
2. Вычислить повышение температуры кипения раствора, если в 320 г воды растворить 15 г этанола (C2H5OН), эбулиоскопическая постоянная воды –Кэб= 0,52 К·кг/моль.
3. Вычислить молярную массу этанола, если при растворении в 550 г воды 65 г этанола понижение температуры замерзания раствора составило 4,78ºC, криоскопическая постоянная воды - Ккр=1,86 К·кг/моль.
4. Вычислить осмотическое давление раствора при температуре 26ºC, если в 1 литре раствора содержится 140 г глюкозы.
5. При растворении в 850 г воды 25 г сульфата марганца экспериментальное значение повышения температуры кипения раствора составило 0,18ºC, эбулиоскопическая постоянная воды – Кэб =0,52 К·кг/моль. Вычислить степень диссоциации сульфата марганца.
Лабораторная работа № 3
|
|
|


