 |
1.5.1 Представление об общем степенном законе для межмолекулярных взаимодействий (XIX век)
|
|
|
|
1. 5. 1 Представление об общем степенном законе для межмолекулярных взаимодействий (XIX век)
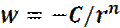
Пусть число молекул в единице объема: ρ
Энергия взаимодействия Е одной конкретной молекулы в системе со всеми остальными составит:
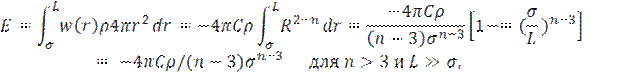
Где σ -диаметр молекул и L – характерный размер системы (например, размер твердого тела или сосуда с газом).
Вклад больших расстояний исчезает только при n > 3.
Конец XIX века: надежды на открытие универсального закона межмолекулярных взаимодействий не оправдались.
Начало XX века: сформировалась современная концепция сил поверхностного натяжения, удерживающих вместе молекулы в твердых телах и жидкостях.
Первые успешные феноменологические теории газов:
1873 год – голландский ученый Ян Дидерик Ван-дер-Ваальс получил новое уравнение состояния газов и жидкостей:
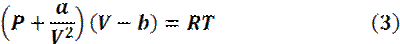
где во втором множителе он вычел множитель B, отвечающий за конечные размеры молекул, а в первый множитель добавил член a/v2, характеризующий притяжение молекул, посредством ван-дер-ваальсовых сил.
XX век: общепризнано, что у межмолекулярных сил сложная природа и единого универсального закона не существует.
1903 год – предложено выражение для парного потенциала взаимодействий, в виде:
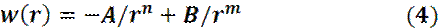
где впервые появилось слагаемое, отвечающее за отталкивание молекул.
потенциал Леннард-Джонса
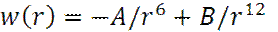
A = 10-77 Дж∙ м6 B = 10-134 Дж∙ м12
1. 6. Зависимость потенциала Леннард-Джонса W(R) (U(R)) от расстояния между атомами R
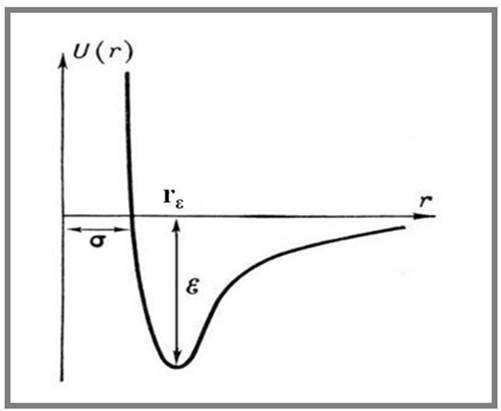
Расстояние r = σ – наименьшее возможное расстояние между неподвижными атомами (молекулами), ε – глубина «потенциальной ямы» (энергия связи атомов (молекул)).
|
|
|
1. 7. Современный взгляд на происхождение межмолекулярных сил
→ 20-е годы XX столетия: построена квантовая теория, позволившая понять природу межмолекулярных сил и вывести уравнения для потенциалов взаимодействия
→ Все межмолекулярные взаимодействия, в сущности, имеют электростатическую природу (Теорема Гельмана-Феймана: если пространственное распределение электронной плотности известно из решения уравнения Шредингера), то межмолекулярные силы можно рассчитать, исходя из тривиальной классической электростатики.
→ Между двумя статическими зарядами наблюдается кулоновское взаимодействие, если они находятся в движении – электромагнитное.
→ В общем случае межатомных и межмолекулярных связей имеется сложное, непрерывно флуктуирующее распределение заряда внутри и вокруг атомов.
→ Решение уравнения Шредингера даже в простых случаях – сложная задача.
1. 8. Энергия взаимодействия молекул в свободном пространстве и в средах
Парный потенциал W(r) характеризует энергию взаимодействия двух молекул в вакууме.
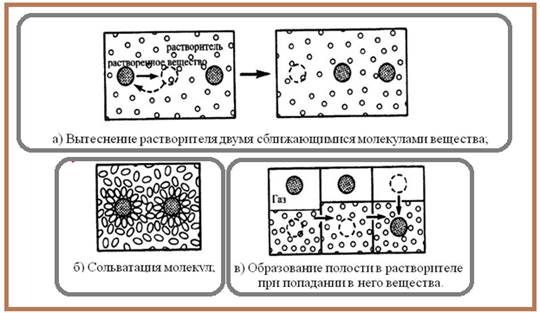
При рассмотрении силы между молекулами или частицами в жидкости, возникает ряд эффектов, обусловленных присутствием молекул растворителя, так как происходит взаимодействие системы многих тел:
1. ) Для двух молекул растворенного вещества в растворителе, парный потенциал W(r) включает не только энергию непосредственного взаимодействия молекул, но и энергии взаимодействия молекул с растворителем и молекул растворителя между собой;
2. ) Молекулы вещества часто нарушают локальную структуру молекул растворителя. Возникает дополнительная сольватация;
3. ) Взаимодействие вещество-растворитель может изменить свойства растворенных молекул (например, дипольный момент, степень ионизации);
4. ) Когда индивидуальная молекула вводится в конденсированную среду, необходимо затратить энергию на формирование полости для размещения чужой молекулы.
|
|
|
|
|
|


