 |
ионоселективных электродов (ионометрия)
|
|
|
|
Ионометрический метод анализа основан на измерении потенциала ионоселективного электрода в зависимости от активности (концентрации) различных ионов в системах со сложным солевым составом. Ионоселективный электрод – индикаторный электрод, избирательно реагирующий на изменение активности только определённых ионов в растворе. Примером ионоселективного электрода на ионы водорода является стеклянный электрод, и методика анализа с использованием других ионоселективных электродов аналогична измерению рН. В основе аналитических методов с использованием ионоселективных электродов лежит уравнение Нернста в его эмпирической форме:
Е = Е 0  S · lg а, (2.3)
S · lg а, (2.3)
где а – активность потенциалопределяющих ионов,
Е – ЭДС электродной измерительной цепи,
Е 0 – ЭДС электродной измерительной цепи с а = 1 моль/дм3 .
 S – угловой коэффициент – крутизна электродной функции, теоретическое значение которой при 25 0С составляет 59,16 мВ/ед. заряда на порядок активности.
S – угловой коэффициент – крутизна электродной функции, теоретическое значение которой при 25 0С составляет 59,16 мВ/ед. заряда на порядок активности.
Это уравнение в координатах Е = ƒ(lg а) представляет собой прямую линию. Для описания прямой достаточно значения двух параметров или двух точек, или одной точки и углового коэффициента.
Ионоселективный электрод состоит из цилиндрического корпуса, выполненного из стойкого неэлектропроводного материала (рисунок 2.8). В нижней части корпуса герметично закреплён чувствительный элемент – мембрана (электродноактивное вещество). Внутри корпуса залит электролит постоянной концентрации с погружённым в него, обычно хлорсеребряным полуэлементом. Мембрана разделяет два раствора – внутренний и внешний (измеряемый), находящийся в контакте с её поверхностями. Перенос заряда через мембрану возможен только ионами определенного вида. При погружении электрода в анализируемый раствор начинается движение ионов в направлении раствора с более низкой концентрацией иона-переносчика заряда; в мембране возникает потенциал, препятствующий дальнейшему перемещению ионов. В конечном счете, устанавливается такое равновесие, при котором потенциал внутри мембраны точно соответствует величине, необходимой для предотвращения дальнейшего движения ионов. Для измерения мембранного потенциала надо обеспечить электрический контакт с внутренним раствором (для этого используют соответствующий внутренний электрод сравнения) и внешним раствором (обычно применяют вспомогательный электрод сравнения).
|
|
|

Рисунок 2.9 - Ионоселективный электрод:
1 – внутренний (стандартный) раствор; 2 – внутренний электрод сравнения
(Ag + AgCl); 3 – корпус электрода; 4 – чувствительная мембрана
Потенциал мембранного электрода складывается, таким образом, из потенциала внутреннего электрода сравнения и потенциалов на внутренней и наружной поверхности мембраны. При постоянной температуре состав внутреннего раствора остаётся неизменным, и изменение потенциала ионоселективного мембранного электрода соответствует изменению потенциала на наружной поверхности мембраны, т.е. изменению концентрации потенциалопределяющих ионов в растворе. Разность потенциалов измеряется высокоомным вольтметром, подключённым к выводам вспомогательного электрода сравнения и ионоселективного электрода (рисунок 2.10)

Рисунок 2.10 - Измерительная схема
с использованием ионоселективных электродов:
1 – ионоселективный электрод; 2 – электрод сравнения;
3 – анализируемый раствор; 4 – измерительный прибор
В зависимости от применяемого электродноактивного материала ионоселективные электроды разделяются на электроды с твёрдыми и жидкими мембранами. Электродами с твёрдыми мембранами являются стеклянные электроды, электроды с кристаллической мембраной и гомогенные и гетерогенные осадочные мембранные электроды. Конструктивно все ионоселективные электроды имеют много общего (рисунок 2.11).
|
|
|
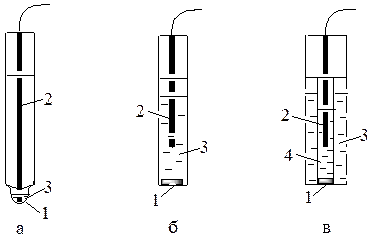
Рисунок 2.11 - Конструкции различных ионоселективных электродов:
а - стеклянный электрод, б - электрод с твёрдой мембраной, в - электрод с жидкой мембраной; 1 – мембрана; 2 – внутренний электрод сравнения (AgCl/Аg);
3 – внутренний (стандартный) раствор; 4 – жидкий ионообменник
Твёрдая мембрана представляет собой малорастворимое соединение, обладающее ионной проводимостью. Электроды с такой мембраной “откликаются” на ионы, переносимые через мембрану, и на противоионы, образующие с первыми малорастворимое соединение мембраны, так как концентрации этих ионов в растворе связаны между собой произведением растворимости.
Твёрдой мембраной может быть монокристалл с ионной проводимостью при комнатной температуре. Перенос заряда в кристалле происходит за счёт дефектов кристаллической решётки, когда вакансии заполняются только определёнными видами ионов, идеально соответствующими определённому иону в отношении размера, формы и распределения заряда. Посторонние ионы не могут войти в кристалл и перемещаться в нём. Если мембрана не обладает механической прочностью, её вводят в инертную матрицу (каучук, полистирол и т.д.) – такая мембрана называется гетерогенной.
Электроды с твёрдыми мембранами: фторид-селективный на основе электродноактивного соединения LaF3, сульфид-селективный на основе Ag2S, Cl-селективный на основе Ag2S + AgCl и т. д.
Жидкие мембраны представляют собой не смешивающуюся с водой органическую жидкость (растворитель с растворённым в нём ионообменным веществом), которая обладает селективным свойством проникновения через неё различных ионов. Жидкая мембрана находится в контакте с двумя водными растворами и должна быть практически нерастворима в них. Этим требованиям отвечают органические вещества с низкой диэлектрической проницаемостью и большим молекулярным весом. В качестве жидких мембран применяют органические ионообменники (четвертичные аммониевые и фосфониевые основания), нейтральные носители и биологически активные вещества (валиномицин, нонактин и др.). Все эти электроды высокоизбирательны и широко используются в практике.
|
|
|
Важной характеристикой ионоселективного электрода является его коэффициент селективности (избирательности), показывающий во сколько раз электрод более чувствителен к данным ионам, чем к посторонним (мешающим). Мешающее влияние ионов можно оценить с помощью коэффициента селективности по уравнению Никольского:
 (2.4)
(2.4)
где i – потенциалопределяющий ион,
j – мешающий ион,
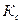 может быть больше 1, тогда электрод “чувствует” мешающий ион больше, чем определяемый;
может быть больше 1, тогда электрод “чувствует” мешающий ион больше, чем определяемый;
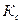 < 1 – электрод селективен к определяющему иону;
< 1 – электрод селективен к определяющему иону;
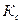 = 1 – электрод “чувствует” и определяемый и мешающий ион.
= 1 – электрод “чувствует” и определяемый и мешающий ион.
Электрод должен иметь низкие значения селективности.
В настоящее время имеются ионселективные электроды для определения ионов F-, Cl-, Br-, I-, CN-, S-, Ag+, SCN-, Cu2+, Pb2+, Cd2+, NO3-, K+, Ca2+, Mg2+ и др.
Метод ионометрии обладает рядом преимуществ перед другими методами анализа. Метод прост, удобен, требует малое количество времени для определения анализируемого вещества, позволяет проводить измерения ЭДС чрезвычайно малых проб, меньше 1 см3 и без разложения анализируемого раствора. Но селективность созданных электродов ещё недостаточно высока, а возможность создания электродов, чувствительных к многозарядным ионам, ограничена точностью измерения ЭДС, так как при 10-кратном изменении активности для однозарядных ионов изменение потенциала составляет 59,16 мВ, для двухзарядных – 28,56 мВ, для трёхзарядных – 19,72 мВ.
Мембранные ионоселективные электроды имеют большое сопротивление, и для измерения ЭДС с мембранными электродами применяют потенциометры на основе усилительных схем. Для этой цели служат ионометры и рН-метры различных марок (рН-340, рН-121, рН-262, рН-673 и др.).
Так как применение расчётных методов определения концентраций ионов (по уравнению (2.3)) сопряжено со значительными трудностями, то в ионометрии пользуются двумя методами относительных измерений с использованием стандартных растворов:
|
|
|
1 – метод градуировочного графика,
2 – метод стандартных добавок.
Потенциометрическое титрование в водных и неводных средах
Потенциометрическое титрование, в котором используются все типы химических реакций, предполагает для фиксирования ЭДС использование индикаторного электрода (отвечающего на изменение концентрации определённого типа ионов) и электрода сравнения, имеющего не изменяющийся при титровании потенциал.
В процессе кислотно-основного титрования изменяется концентрация ионов водорода, поэтому в качестве индикаторных используются электроды, обратимые относительно ионов Н+ (хингидронный, водородный, стеклянный). Изменение рН влияет на величину электродного потенциала в соответствии с уравнением Нернста:
Е = Е 0 + 0,059· lg[H+] = E 0 – 0,059·pH
Графическое изображение зависимости электродного потенциала от объёма добавленного титранта даёт кривая титрования, общий вид которой представлен на рисунке 2.12.

Рисунок 2.12 – Нахождение точки максимального перегиба
|
|
|


