 |
7. Тканевый распад белков. Роль шаперонов и убиквитина в этом процессе.
|
|
|
|
7. Тканевый распад белков. Роль шаперонов и убиквитина в этом процессе.

Распад тканевых белков происходит из-за старения клетки, денатурации белков, частичного протиолиза, при переваривании. В переваривании белков в тканях принимает участие убиквитин, который связывается с белком и дает сигнал ферментам.
Шапероны – универсальные консервативные белки, которые связывают другие белки и стабилизируют их конформацию. Они могут исправлять недостатки белков как после их синтеза, так и в процессе синтеза на рибосомах. Взаимодействуя с полипептидами, шапероны предотвращают ошибки в сворачивании и сборке и этим препятствуютаггрегации полипептидных цепей. Одна из главных функций шаперонов — сворачивание и разворачивание (unfolding), а также сборка и разборка белков при их транспорте через мембраны
Убиквитин. При обезвоживании клеток, несмотря на действие протекторных соединений и шаперонов, часть клеточных белков подвергается денатурации. Денатурированные белки должны быть гидролизованы. Эту функцию выполняют протеазы и убиквитины. Убиквитины представляют собой низкомолекулярные (8, 5 кДа) высококонсервативные белки. Присоединяясь к N-концу денатурированного белка, они делают белок доступным для действия протеаз Таким путем осуществляется селективная деградация денатурированных белков в протеосомах. Т. о., связывание белка с убиквитином служит сигналом для «узнавания» этого белка протеиназами, что обеспечивает механизм избирательной деградации внутриклеточных белков.
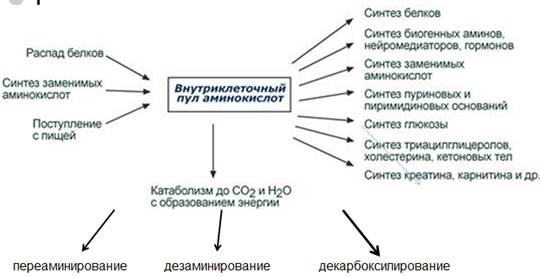
8. Понятие клеточного метаболического пула АК. Пути образования и использования АК в тканях.
В отличие от жиров и углеводов, в организме не существует депо белков. Своеобразным депо является пул аминокислот (фонд свободных Ак), т. е. количество свободных аминокислот, которые образуются: 1) за счет всасывания в кишечнике, 2) при распаде (протеолизе) собственных белков организма (в тканях), 3) путем синтеза denovo (заменимые аминокислоты).
|
|
|
9. Переаминирование аминокислот: общая схема, механизм, биологический смысл и роль во взаимосвязи обмена веществ.
Аминокислоты, появившиеся в организме, включаются в общие и специфические реакции обмена.
К общим реакциям обмена аминокислот относят реакции трансаминирования, дезаминирования и декарбоксилирования, биосинтеза белков и рацемизации (L переходы D).
ТРАНСАМИНИРОВАНИЕ (ПЕРЕАМИНИРОВАНИЕ) АМИНОКИСЛОТ
Трансаминирование — реакция переноса α -аминогруппы с аминокислоты на α -кетокислоту, в результате чего образуются новая α -кетокислота и новая аминокислота. Процесс трансаминирования легко обратим, при нем общее количество аминокислот в клетке не меняется.
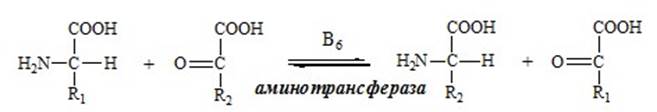
Реакции катализируют аминотрансферазы, коферментом которых служит пиридоксальфосфат (ПФ) — производное витамина В6 (пиридоксина).

У человека найдено более 10 аминотрансфераз, которые локализуются в цитоплазме и митохондриях клеток. Обязательным условием трансаминирования является участие дикарбоновых аминокислот (глутаминовой и аспарагиновой), которые в виде соответствующих им кетокислот - a-кетоглутаровой и щавелевоуксусной могут взаимодействовать со всеми аминокислотами, за исключением лизина, треонина и аргинина.
|
|
|


