 |
11.Дезаминирование аминокислот. Виды дезаминирования. Аминокислотные оксидазы и дегидрогеназы. Непрямоедезаминирование, последовательность реакций, ферменты, биологическая роль.
|
|
|
|
11. Дезаминирование аминокислот. Виды дезаминирования. Аминокислотные оксидазы и дегидрогеназы. Непрямоедезаминирование, последовательность реакций, ферменты, биологическая роль.
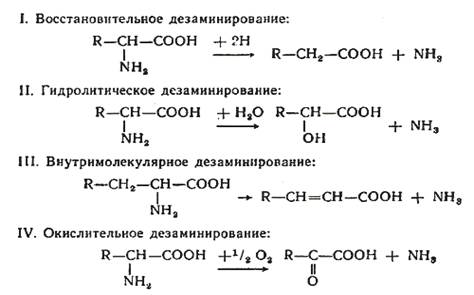
Дезаминирование аминокислот — реакция отщепления α -аминогруппы от аминокислоты, в результате чего образуется соответствующая α -кетокислота и выделяется молекула аммиака.
Дезаминирование бывает прямым и непрямым.
Прямое дезаминирование аминокислоты
Прямое дезаминирование – это дезаминирование, которое происходит в 1 стадию с участием одного фермента. Прямомудезаминированию повергаются глу, гис, сер, тре, цис.
Существует 5 видов прямогодезаминирования аминокислот:
- 1. окислительное;
- 2. неокислительное;
- 3. внутримолекулярное;
- 4. восстановительное;
- 5. гидролитическое.
Окислительноедезаминирование – самый активный вид прямого дезаминирования аминокислот.
1. Глутаматдегидрогеназа (глу-ДГ) – олигомер, состоящий из 6 субъединиц (молекулярная масса 312 кД), содержит кофермент НАД+. Глу-ДГ катализирует обратимоедезаминированиеглу, очень активна в митохондриях клеток практически всех органов, кроме мышц. Глу-ДГ аллостерически ингибируют АТФ, ГТФ, НАДH2, активирует избыток АДФ. Индуцируется Глу-ДГ стероидными гормонами (кортизолом).
Реакция идёт в 2 этапа. Вначале происходит ферментативное дегидрирование глутамата и образование α -иминоглутарата, затем — неферментативное гидролитическое отщепление иминогруппы в виде аммиака, в результате чего образуется α -кетоглутарат. При избытке аммиака реакция протекает в обратном направлении (как восстановительное аминированиеα -кетоглутарата).

Глу + НАД+ + Н2О ↔ α -КГ + НАДН2 + NH3
|
|
|
2. Оксидаза L-аминокислот
В печени и почках есть оксидаза L-АК, способная дезаминировать некоторые L-аминокислоты:

Оксидаза L-АК имеет кофермент ФМН. Т. к. оптимум рН оксидазы L-АК равен 10, 0, активность фермента очень низка и вклад ее в дезаминирование незначителен.
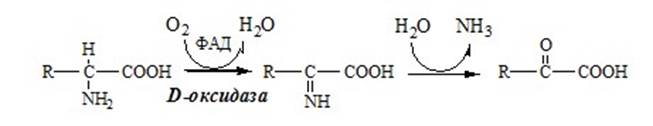
3. Оксидаза D-аминокислот
Оксидаза D-аминокислот также обнаружена в почках и печени. Это ФАД-зависимый фермент, с оптимумом рН в нейтральной среде. Оксидаза D-аминокислот превращает, спонтанно образующиеся из L-аминокислот, D-аминокислоты в кетокислоты.
Неокислительное дезаминирование
В печени человека присутствуют специфические пиридоксальфосфатзависимые ферменты сериндегидратаза, треониндегидратаза, катализирующие реакции неокислительного дезаминирования аминокислот серина и треонина.

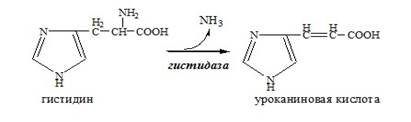
Внутримолекулярноедезаминирование
Внутримолекулярное дезаминирование характерно для гистидина. Реакцию катализирует гистидаза (гистидин-аммиаклиаза). Эта реакция происходит только в печени и коже.
Непрямоедезаминирование (трансдезаминирование) аминокислот
Непрямое дезаминирование – это дезаминирование, которое происходит в 2 стадий с участием нескольких ферментов. Оно характерно для большинства аминокислот, так как они не способны к прямомудезаминированию (нет ферментов).
На первой стадии происходит одна и несколько реакций переаминирования с участием аминотрансфераз, в результате аминогруппа аминокислоты переходит на кетосоединение (α -КГ, ИМФ).
На второй стадии происходит реакция дезаминированияаминосоединения (глу, АМФ), в результате чего образуется аммиак.
Последовательность реакций непрямого дезаминирования зависит от набора ферментов в тканях.
Непрямоедезаминирование в печени
Непрямое дезаминирование аминокислоты происходит при участии 2 ферментов: аминотрансферазы и глу-ДГ. Аминогруппы аминокислоты в результате трансаминирования переносятся на α -КГ с образованием глутамата, который затем подвергается прямому окислительному дезаминированию.
|
|
|

Обе стадии непрямого дезаминирования обратимы, что обеспечивает как катаболизм аминокислот, так и возможность образования практически любой АК из соответствующей α -кетокислоты.
При энергодефиците АДФ активирует Глу-ДГ, что усиливает катаболизм аминокислот и образование а-кетоглутарата, поступающего в ЦТК как энергетический субстрат.
Таким образом, Глу-ДГ играет ключевую роль в регуляции обмена аминокислот и энергии.
Непрямоедезаминирование в мышцах (и нервной ткани)
В мышечной ткани активность глу-ДГ низка, поэтому при интенсивной физической нагрузке функционирует ещё один путь непрямого дезаминирования с участием цикла ИМФ-АМФ.

Можно выделить 4 стадии этого процесса:
- 1. трансаминирование с а-кетоглутаратом, образование глутамата (аминотрансфераза);
- 2. трансаминированиеглутамата с ЩУК, образование аспартата (АСТ);
- 3. реакция переноса аминогруппы от аспартата на ИМФ (инозинмонофосфат), образование АМФ и фумарата (аденилосукцинасинтаза и аденилосукцинатлиаза);
- 4. гидролитическое дезаминирование АМФ (АМФ-дезаминаза).
Этот путь дезаминирования преобладает в мышцах при интенсивной работе, в результате которой накапливается молочная кислота. Выделяющийся аммиак предотвращает закисление среды в клетках, вызванное образованием лактата.
|
|
|


