 |
Процессы замораживания и размораживания
|
|
|
|
Температура и режим процессов не должны снижать пищевые и по возможности вкусовые ценности продуктов.
Продукты бывают охлажденные и быстрозамороженные.
Охлаждение производят до обычной температуры: 3–10оС,
до низкой температуры: 0–3оС, замораживание при температуре: 30–0оС.
Способы охлаждения жидких продуктов:
1) в аппаратах через стенку;
2) в холодильных камерах;
3) путем вакуумированной жидкости;
4) путем смешения;
5) помещением льда в сосуд;
6) помещением сосуда в лед.
Способы охлаждения и замораживания твердых продуктов:
1) непосредственный контакт с охлаждающей поверхностью;
2) непосредственный контакт с жидким или газообразным хладагентом.
Тепловой баланс: 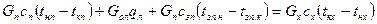
где л – лед.
Материальный баланс: 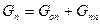
где Gп –начальное количество, Gоп – конечное количество, Gпп – потери.
ЛЕКЦИЯ 13- 14
МАССООБМЕННЫЕ ПРОЦЕССЫ
Теоретические основы
Массообменные процессы – процесс перехода вещества из одной фазы в другую.
Виды массообменных процессов:
1.Абсорция
2.Адсорбция
3.Экстракция
4.Ректификация
5.Сушка
6.Крисстализация
Массообменные процессы осуществляются за счет диффузии при с1< ср< с2, ср – равновесная концентрация.
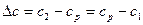
так как обычно равновесие не достигается, то считается Dсф разность концентраций в конце процесса и начале.
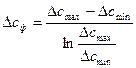
Уравнение молекулярной диффузии (Фика): 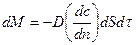
где dM – количество диффундированного вещества, D – коэффициент молекулярной диффузии, 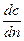 – градиент концентрирования.
– градиент концентрирования.
1.Массопередача: 
где Км – коэффициент массопередачи, м/с.
2.Массоотдача (происходит между границей раздела и фазой):
 – (уравнение Щукарева)
– (уравнение Щукарева)
b - коэффициент массоотдачи.
3.В твердом веществе массопроводность: 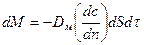 ,
,
|
|
|
где Дм – коэффициент массопроводности.
Абсорбция
Абсорбция – процесс поглощения газов (паров) из газовых (парогазовых) смесей жидкими поглотителями (абсорбентами). Они должны обладать избирательной поглотительной способностью: жидкость – абсорбент, газ – абсорбтив. Например: насыщение напитков углекислым газом, поглощение пара из воздуха складов.
Количество растворенного газа зависит от парциального давления (закон Генри):  , моль/м3, где
, моль/м3, где  – коэффициент, зависит от свойств абсорбента.
– коэффициент, зависит от свойств абсорбента.
Уравнение фазового равновесия: у = Н х, где у – доля компонентов в смеси, х – доля абсорбента.
 – константа фазового равновесия; Y – коэффициент пропорциональности.
– константа фазового равновесия; Y – коэффициент пропорциональности.
Материальный баланс: 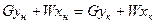 или
или 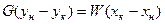
где G – количество газа, W – количество абсорбента.
Удельный расход абсорбента: 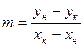 , кг/кг
, кг/кг
Аппараты: пленочные, насадочные, барбатажные абсорберы.
Адсорбция
Адсорбция – поглощение одного или несколько компонентов из газовой смеси твердым веществом. Адсорбент – поглощает (капилляры или поры с большой поверхностью), адсорбтив – поглощается. Адсорбенты: древесный, костный уголь, цеолиты, иониты, целлюлозная масса. Удельная поверхность: 1700 м2/г.
Материальный баланс: 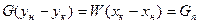
Где, G –адсорбтив, W –адсорбент, Gп –количество поглощенного вещества.
Количество адсорбируемого вещества определяют по:  ,
,
b – коэффициент массоотдачи, м/с; DС – средняя разность концентрации, кг/м.
Аппараты – адсорберы, часто колонного типа.
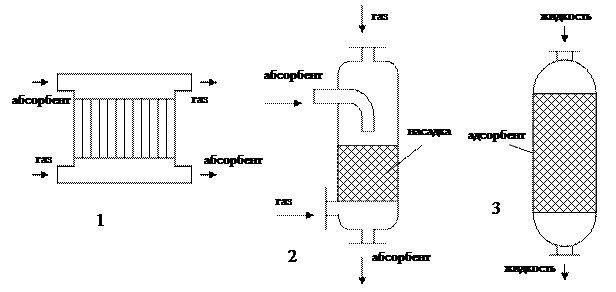
1 – пленочный абсорбер, 2 – насадочный абсорбер, 3 – адсорбер колонного типа
Рисунок 6.1 – Аппараты для сорбционных процессов
Экстракция
Извлечение одного или несколько компонентов из растворов или твердых тел избирательным растворителем или твердым веществом (экстрагентами).
Экстракция применяется в производстве сахара, растительных масел, витаминном производстве, вина.
Материальный баланс: 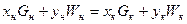 ,
,
|
|
|
х, G – концентрация и количество продукта, у, W – экстрагент.
Аппараты: экстракторы колонного типа, мешалки.
Ректификация
Ректификация (перегонка, дистилляция) – испарение летучих компонентов с последующей конденсацией.
1.Простая перегонка (получение дистиллированной воды).
2.Ректификация – разделение многокомпонентных систем (спиртовое производство).
Уравнение материального баланса:
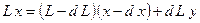
где L – количество исходной системы,  - количество испаренной жидкости,
- количество испаренной жидкости,  - концентрация компонента в исходной фазе и дистилляте.
- концентрация компонента в исходной фазе и дистилляте.
Материальный баланс в упрощенном виде: L=Lo+Дд, где L –количество исходной системы, Lо – остаток, Дд – дистиллят.
Тепловой баланс: 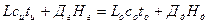

Рисунок 6.2 – Схема процесса ректификации
Аппараты: ректификационные колоны, дистилляторы.
ЛЕКЦИЯ 15
Сушка
Сушка – тепломассообменный процесс для обезвоживания продуктов (зерно, овощи и фрукты, хлеб, мясо, молоко, яйца).
Кинетика сушки (закон Фика): 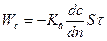 – перенос влаги за счет разности концентрации, Кв – коэффициент влагопроводности, м2/с.
– перенос влаги за счет разности концентрации, Кв – коэффициент влагопроводности, м2/с.
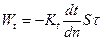 – перенос за счет разности температур, Кt – коэффициент термовлагопроводности, кг/м оКс.
– перенос за счет разности температур, Кt – коэффициент термовлагопроводности, кг/м оКс.
Общее количество перенесенной влаги: 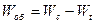
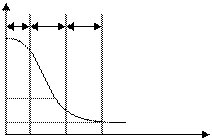
Процесс сушки можно изобразить графически. Строят 2 кривые.

 W,% I II III dW/dt
W,% I II III dW/dt
 |


 WO
WO
I II III IV V
WK
WP
 | |||
r1 rk rp r WP WKP WO W, %
1 - Кривая сушки, 2 - Кривая скорости сушки
Рисунок 6.3 – Графики сушки
Процесс делят на 3 периода:
I – подогрев (испарения мало)
II – период постоянной скорости сушки (основное испарение)
III – период падающей скорости сушки.
Уравнение материального баланса:
1.  , Wуд – количество удаленной влаги, Gи – количество исходного продукта, Gс – количество сухого продукта.
, Wуд – количество удаленной влаги, Gи – количество исходного продукта, Gс – количество сухого продукта.
2. 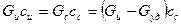 сс – концентрация сухих веществ.
сс – концентрация сухих веществ.
3.  W – содержание влаги, %.
W – содержание влаги, %.
Тепловой баланс: 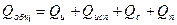 Qи – нагрев исходного продукта, Qс – уносится с сухим продуктом.
Qи – нагрев исходного продукта, Qс – уносится с сухим продуктом.

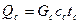
Сушка бывает: 1) естественная; 2) искусственная.
Искусственная сушка делится:
1) конвективная (сушильный агент – воздух, пар нагретый, газы);
2) контактная (через стенку);
3) радиационная (ИК);
4) диэлектрическая (ВЧ, СВЧ);
5) сублимационная (вакуум).
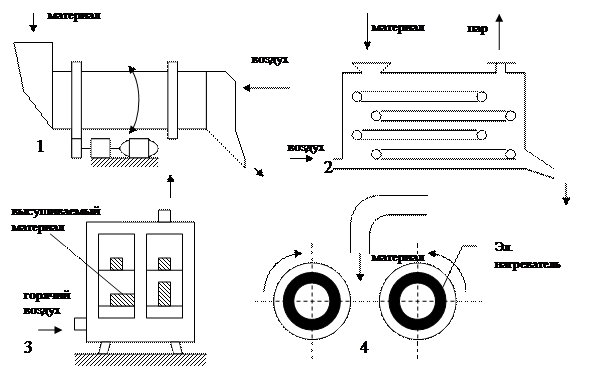
Конвективная сушка бывает непрерывного и периодического действия. Конвективные сушилки: камерные шкафы, ленточные, барабанные, КС.
|
|
|
Контактные сушилки: шкафные, вальцовые.
 |
1 – барабанная, 2 – ленточная, 3 – камерная (шкаф),
4 вальцовая, 5 – шкафная контактная
Рисунок 6.4 - Сушилки
Количество горячего воздуха: 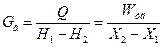
Х – влагосодержание, кг/кг.
Количество пара для контактной сушилки: 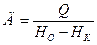
НО – энтальпия острого пара, НК – энтальпия конденсата.
Кристаллизация
Кристаллизация – процесс выделения твердой фазы из растворов и расплавов. Химическое вещество может иметь несколько кристаллических форм – полиморфизм. Кристаллизация применяется в производстве сахара, соли, сгущенного молока, лимонной кислоты. Кристаллизация состоит из двух стадий: 1) образование зародыша, 2) его рост. Кристаллизация происходит из насыщенного раствора (равновесная концентрация).
Материальный баланс:
1) для раствора: 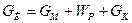
где GИ – масса исходного раствора, GМ – масса маточного раствора, WР – масса растворителя, GК – масса кристаллов.
2) для кристаллизированного вещества: 
где Х – концентрация кристаллизированного вещества в исходном, маточном растворах и кристаллах.
Четыре способа кристаллизации:
1) Охлаждение – для получения пересыщенного раствора.
2) Выпаривание растворителя.
3) Одновременное охлаждение и выпаривание.
4) Высаливание – добывают вещество, снижающее растворимость основного вещества (для NaCl это MgCl2).
Аппараты для кристаллизации:
1) Кристаллизаторы с рубашкой и мешалкой (мешалка ускоряет охлаждение и препятствует осаждению).
2) Кристаллизаторы с системой охлаждения и вакуумирования.
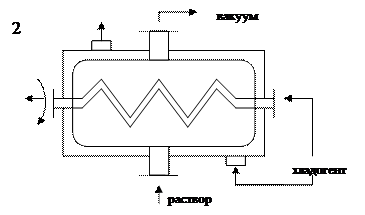 | |||
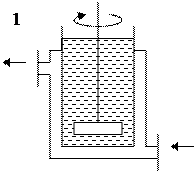 | |||
1 - кристаллизаторы с рубашкой и мешалкой, 2 - кристаллизаторы с системой охлаждения и вакуумирования
Рисунок 6.5 - Кристаллизаторы
Растворение
Растворение во многих случаях сопутствующий процесс (сорбция, экстракция, варка, жарка), часто основной – сахарные сиропы, растворы соли, растворение сухих продуктов. При растворении всегда есть граница раздела между твердой фазой и жидкостью.
|
|
|
Процесс состоит из трех стадий:
1) Перенос молекул растворителя к поверхности твердого вещества;
2) Переход молекул твердого тела в жидкость, контактируя с ним;
3) Перенос молекул твердого тела от поверхности в объем.
Лимитирующая стадия последняя, так как наибольшее сопротивление переносу происходит в диффузионном пограничном слое, где раствор является насыщенным.
Движущая сила процесса - DС между концентрацией растворенного вещества в пограничном слое и в объеме.
Поэтому кинетика процесса: 
где GP – масса растворенного вещества; b - коэффициент массоотдачи, м/с; S – поверхность контакта жидкости и твердого тела; СС – пограничный слой; СЖ – в объеме.
Из уравнения: скорость реакции растет когда 1) S увеличивается, значит надо измельчить, площадь шарообразной формы увеличивается.
2) при увеличении b увеличивается Re, температура увеличивается, температура растворенного вещества увеличивается, так как тепловой поток направлен от твердого тела к жидкости и не может массопередачи, DС увеличивается.
Аппараты растворения: мешалки, мешалки с подогревом, аппарат для растворения сухих молочных продуктов.
Порошок Вода Вода (для доведения концентрации до
 оптимальной величины)
оптимальной величины)
смесь
БИОХИМИЧЕСКИЕ ПРОЦЕССЫ
Биохимическими процессами называют процессы направленной жизнедеятельности микроорганизмов, скорость которых определяется приростом биомассы либо продуктов их метаболизма.
Биохимические процессы осуществляются с помощью живых микроорганизмов. Они потребляют из окружающей среды-субстрата питательные вещества – сахарозу, глюкозу, лактозу и другие углеводы. Микроорганизмы дышат, растут, размножаются, выделяют газообразные и жидкие продукты метаболизма, ради чего и проводится процесс ферментации.
Микробиологический синтез используют для получения ряда ценных продуктов, производство которых методами химической технологии невозможно или экономически нецелесообразно. Например, получение ферментов, бактериальных препаратов, белка, антибиотиков, ряда витаминов возможно только путем микробиологического синтеза.
В пищевой промышленности микроорганизмы используются в бродильных производствах – пивоварении, виноделии, в производстве пищевого спирта, лимонной, молочной и уксусной кислот, дрожжей, а также при переработке сельскохозяйственного сырья. Синтезпроводят в аппаратах, которые называют ферментаторами. Процесс микробиологического синтеза проводят в ферментаторах периодического и непрерывного действия. Целевой продукт выделяют из культуральной жидкости путем фильтрования, сепарации, экстракции, выпаривания и сушки. Наиболее распространенными методами сушки являются распылительные, сублимационные, вакуумные и сушка в псевдоожиженном слое.
|
|
|
Особенности биохимических процессов следующие: образование или разрушение различных продуктов с помощью живых микроорганизмов; саморегулирование, которое обычно направлено на ускорение роста биомассы. Кроме того, все внутриклеточные процессы протекают и регулируются белковыми биокатализаторами – ферментами, клеточные оболочки – мембрана обладает избирательной проницаемостью, на внешнее воздействие регуляторные механизмы клетки реагируют приспособительной реакцией, направленной обычно в благоприятную для жизнедеятельности микроорганизмов сторону.
Общая скорость л=биомассы микроорганизмов (в кг/(м3×ч)) представляет собой отношение прироста биомассы dM за бесконечно малый промежуток времени dt. Эта скорость пропорциональна концентрации биомассы.
Кинетика роста биомассы микроорганизмов описывается уравнением:

где М – концентрация биомассы, кг/м3; t - продолжительность процесса, ч; К – удельная скорость роста биомассы, ч-1.
Удельная скорость: 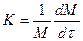
Концентрация биомассы возрастает по экспоненциальному закону:

Для роста популяции аэробных микроорганизмов требуется кислород, котрый окисляет органические субстраты и обеспечивает клетки энергией. Кислород плохо растворяется в воде, и его концентрация в воде составляет 8,1 мг/л. Поэтому для обеспечения процесса ферментации необходима непрерывная аэрация ферментационной жидкости воздухом.
При аэрации происходят два процесса: абсорбция кислорода ферментационной жидкостью из пузырьков воздуха и усвоение растворенного в жидкости кислорода клетками микроорганизмов.
Для жидкой фазы уравнение массоотдачи: 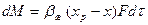
Где М – концентрация кислорода, кг; bж – коэффициент массоотдачи в жидкой фазе, м/ч; хр – равновесные концентрации кислорода, кг/м3; F – площадь поверхности массоотдачи, м2; t - продолжительность процесса, ч.
Коэффициент массоотдачи в жидкой фазе зависит от скорости перемешивания среды и условий аэрации. Концентрация кислорода в отходящем из ферментатора воздухе составляет 18…20%.
Базовая литература
1. Н.Н. Липатов. Процессы и аппараты пищевых производств. М.: Экономика, 1987. – 272 с.
2. М.А. Адилбеков, А.С.Калыкова, М.Т. Токбаев, Е.Б. Медведков. Методические указание по выполнению лабораторных работ по ПАПП, Алматы, Изд. АТУ, 1998-52с.
Рекомендуемая литература
3. Кавецкий Г.Д., Королев А.В. Процессы и аппараты пищевых производств.- М.: Агропромиздат,1991.-432с.
4. Расчеты и задачи по процессам и аппаратам пищевых производств. С.М.Гребенюк, Н.С.Михеева, Ю.П.Грачев и др.-М.: Агропромиздат, 1987-304с.
5. Баранцев щевых производств. Задачник под редакцией Стабникова В.Н. Киев.: «Техника», 1966-243с.
6. Медведков Е.Б. Расчет конвективных сушилок. Учебное пособие для студентов пищевых вузов. Алматы, изд. АТУ, 2000 – 47 с.
7. Бекбаев А.Б., Колесникова Э.Ф., Шалбаев К.К. Методические указания по курсовому проектированию. Выпаривание. Алматы. Изд. НМК, 1984 -50 с.
8. М.А. Адилбеков, А.С.Калыкова, М.Т. Токбаев, Е.Б. Медведков. Методические указание по выполнению лабораторных работ по ПАПП, Алматы, Изд. АТУ, 1998-52с.
9. Е.Б. Медведков, М.А. Адильбеков, К.К.Кузембаев. Программа, методические указания и контрольные задания по ПАПП для студентов спец.4210- Технология и организация питания. Алматы. Изд. АТУ, 1998-54стр.
10. Проектирование процессов и аппаратов пищевых производств. Под редакцией Стабникова В.Н.-Киев.:1982.-198стр.
12.2. Практические занятия «Не предусмотрены планом»
Лабораторные занятия
ЛАБОРАТОРНАЯ РАБОТА №6
ИЗУЧЕНИЕ КИНЕТИКИ СУШКИ
Цель работы: Изучение протекаемого процесса сушки во времени
и построение кривых скорости сушки.
I. Теоретические сведения
Обезвоживание твердых и влажных пищевых материалов осуществляют двумя способами:
1. Без изменения агрегатного состояния. При этом способе
влага удаляется механическим путем, например - прессованием
центрифугированием. Способ позволяет удалить лишь часть не
химически связанной влаги из материала.
2. С изменением агрегатного состояния влаги. При этом способе к материалу подводится тепло, с целью удаления влаги из
него в виде пара. Такой процесс удаления влаги из материалов называют тепловой сушкой или просто сушкой.
По способу передачи тепла материалу различают:
Конвективную сушку - сушку горячим воздухом или топочными газами. При соприкосновении с горячим газом материал нагревается, влага из него испаряется и в виде пара удаляется с газом. Газ является теплоносителем и влагопоглотителем и называется сушильным агентом.
W = G
где: - масса влаги в материале, кг;
- масса влажного материала, кг;
- масса абсолютного сухого материала, кг.
Влагосодержанием материала - называется отношение массы
влаги к массе абсолютного сухого материала, кг/кг:
Влага из материала будет переходить в окружающий воздух, /т.е. произойдет процесс сушки/.
Обозначив количество испаряющихся при сушке влаги δω, поверхность фазового контакта F и время сушки δτ, выразим скорость сушки как
Скорость сушки существенно изменяется с изменением влажности материала. В начале процесса скорость сушки оказывается постоянной, независящей от материала. В этот период постоянной скорости, или первый период, испарение влаги из материала происходит как со свободной поверхности воды. В процессе сушки в этот период лимитируется конвективный диффузией паров воды с поверхности раздела фаз в ядро воздушного потока. Диффузное сопротивление влагопроводимости
внутри влажного материала не оказывает существенного влияния на процесс сушки в первый период и скорость сушки определяется только диффузией во внешней области.
Кинематический закон для периода воздушной сушки выражается уравнением:
/5/
где: - количество испаряемой влаги в кг/сек;
- коэффициент массоотдачи в кг/м2 сек;
- поверхность фазового контакта, м2;
- парциальное давление водяного пара в насыщенном
воздухе при температуре поверхности влагоотдачи;
- действительное парциальное давление водяного пара в
окружающем воздухе.
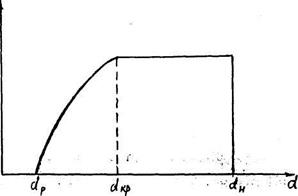
Первому периоду сушки соответствует изменение влагосодержания материала в пределах от dн /начальное влагосодержание/ до dкр /критическое содержание/
При влажности материала ω<ωкр наступает второй период сушки - период уменьшающейся скорости сушки. Для второго периода сушки характерным является то, что процесс сушки в этот период лимитируется массопроводностью внутри влажного материала, а диффузия паров воды от поверхности раздела фаз в ядро воздушного потока не оказывает существенного влияния на процесс сушки.
Кинетический закон для периода выражается уравнением:
/6/
где: - количество испаряемой. влаги, кг/с;
- коэффициент скорости сушки в кг/м2 с, кг/(кг.сух.мат);
F - поверхность фазового контакте, м2;
- влагосодержание материала в данный момент в
кг/(кг.сух.мат.):
- равновесное влагосодержание в кг/кг.сух.мат.).
С помощью кривой сушки можно построить кривую скорости сушки. Тангенс угла наклона касательной и кривой в какой-либо точке равен производной δd/δτ, т.е. скорости сушки.
Например, точка D при влагосодержании d тангенс угла
наклона касательно к оси абцисс равен отношению отрезков с учетом масштабов Мd по оси ординат и Мτ по оси абцисс.
Проводя касательные в ряде точек, можно построить кривую скорости сушки. Для этого откладываем по оси абцисс влагосодержание d, по оси ординат соответствующие значения δd/δτ
2. Ход работы
Влажны материал подвергается комбинированной сушке за счет нагрева от поверхности чашки весов и излучения лампы накаливания.
Опыт проводят с использованием влагомера, на чашку которого кладут исследуемый влажный материал, предварительно замерив его размеры /поверхность/ и взвесить.
Передвижную шкалу влагомера подводят верхним делением под стрелку и включают лампу накаливания. Отмечают время опыта. Через 1,5 – 2 мин. записывают показания прибора. Замеры проводят для получения постоянного значения влажности (последние три замера дают одинаковые показания).
По полученным для каждого момента времени значение влажности строят изменения влажности во времени.
3. Контрольные вопросу.
1. В чем состоит цель работы?
2. Назовите способы обезвоживания.
3. Укажите способы передачи тепла материалу.
4. Что такое влагосодержание материала?
5. Почему линия сушки стало кпиеой линией?
ЛАБОРАТОРНАЯ РАБОТА №7.
ОТСТОЙНОЕ ЦЕНТРИФУГИРОВАНИЕ.
Цель работы: 1. Определение скорости осаждения в поле
центробежных сил.
2. Определение расхода мощности на
центрифугировании.
1. Теоретические сведения.
Осаждение в поле центробежных сил применяется для разделения суспензий и эмульсий. Процессы осождения в поле центробежных сил тяжести, поскольку центробежная сила, действующая на частицы, значительно больше их сил тяжести.
Центробежная сила, действующая на частицу:
Где: Рц – центробежная сила, Н;
m – масса частиц, кг;
w – окруж. скорости, м/с; w=πRn/30;
R – радиус вращения, м;
ω – угловая скорость вращения рад./с; ω= πn/30;
n – число оборотов в минуту, об/мин.
Отношения Рц/G=Кр называют фактором разделения. Его велечина показывает во сколько раз центробежная сила больше силы тяжести для одной и той же массы частиц. Соответственно величина фактора разделения может быть подсчитана по одной из равенств:
Величина центробежной силы фактора разделения и окружной скорости, действующих на рассматриваемую частицу, изменяется в зависимости от положения частицы в поле центробежной силы, т.е. от радиуса. Соответственно и скорость осаждения частицы в поле центробежной силы будет меняться.
Значение wo осаждения определяем из критериального уравнения:
Тогда:
Где:
2. Производительность отстойной центрифуги.
Производительность определяется по формуле:
Где: Vδ – объем барабана, м3;
τос – время осаждения, с.
Исходя из общей продолжительности цикла работы и выражения производительности в м3/час. имеет:
Где: Στ = τз+ τп+ τц+ τт+ τв
 - время загрузки
- время загрузки
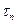 - время пуска
- время пуска
 - время центрифугирования
- время центрифугирования
 - время торможения
- время торможения
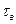 - время выгрузки
- время выгрузки

где: dцил - 0,04 – диаметр цилиндра, м;
hцил - 0,01 – высота, м;
z – количество цилиндров.
3. Расход энергии на центрифугирования.
Мощность в пусковом периоде расходуется на преодоление инерциипокоящейся массы барабана и жидкости N1, на преодоления трения в опорах вала N2, на преодоления трения барабана о воздух N3.
N = N1+N2+N3 /8/
Количество мощности на преодоление инерции покоящейся массы барабана и жидкости определяется:
Где: mб – масса барабана, (mб = 8,3 кг.);
mв – масса воды, кг;
rб – диаметр барабана, (rб = 0,28 м.);
Количество мощности на преодоление трения в опорах вала определяется:
Где: Р – динамическая нагрузка, действующая на подшипники,


dв – диаметр вала, м; (dв = 0,025);
f – коэффициент трения, (f = 0,01);
Количество мощности на преодоление трения барабана о воздух определяется:
Где: hб – высота барабана, hб = 0,2 м.
Энергия электромотора:
Где: 1,2 – дополнительное количество энергии (20% лишней энергии);
η – допустимый КПД, η = 0,85
4. Проведение опыта и обработка результатов.
1. Приготовить суспензию в количестве – 400 мм. с соотношением твердой и жидкой по указанию преподавателя.
2. Открыт барабан центрифуги, залить суспензию в стаканы до половины их объема и установить в барабан закрыв его. Записать продолжительность загрузки τз.
3. Плавно поворачивать ручку автотрансформатора, довести до заданного преподавателем числа оборотов, записать время пуска τn.
4. Работать при заданном числе оборотов/мин. (τц).
5. Для остановки работы плавно повернуть ручку автотрансформатора в нулевое положение, нажать на красную кнопку (тормоз). Записать время торможения до полной остановки τг.
6. После остановки ротора, тумблером (сеть) выключить центрифугу (погаснут сигнальные лампочки), открыть барабан и вынуть стаканы. Осторожно слить осветленную жидкость. Записать время выгрузки τв.
7. Взвесить стаканы с осадком и пустые, определить вес осадка.
8. Произвести расчеты по формулам, приведенным ранее. Подсчитать объем центробежной силы и фактор разделения, производительность и расход энергии при центрифугировании.
5. Контрольные вопросы.
1. В чем цель работы?
2. От чего зависит центробежная сила?
3. Как определяют производительность и расход энергии при центрифугировании?
ЛАБОРАТОРНАЯ РАБОТА № 8
ИСПЫТАНИЕ ЛОПАСТНОГО СМЕСИТЕЛЯ.
Цель работы: 1. Исследовать структурные элементы смесителя.
2. Определить израсходованное количество энергии для
смешивания.
1. Теоретические сведения.
Процесс смешивания находит широкое применение в общественном питании.
При смешивании скорость любого процесса резко возрастает. Процесс смешивания характеризуется производительностью и ее скоростью. Производительность смешивания характеризуется с его качеством, а скорость с временем. Скорость определяется частотой вращения смесительного механизма.
В пищевой промышленности широко применяется процесс смешивания жидких сред. Способы смешения: механический, пневматический, вращательная и искусственная турбулизация.
Механическое смешение происходить при помощи лопастей различной конструкции.
Основная цель работы определение затраты энергии механизмов на вращение. В этом случае считается, что размеры лопастей и физические свойство жидкости известны.
Процессы смешения определяются следующими критериями:
1. Число Эйлера
Число Рейнольдса
Число Фруда
Здесь: N – мощность на валу смесительного аппарата, Вт;
n – частота вращения, 1/с;
ρ – плотность жидкости, кг/м3;
d – диаметр лопасти, м;
μ – коэффициент динамической вязкости, Па ٠ с.
Мощность на валу определяется по формуле:
Если гидравлическое сопротивление определяется только силой трения, то формула (1) упрощается:
Еu = CRem (2)
Здесь: С и m – постоянные числа.
2. Устройство экспериментальной установке.
Установка приведена на рис.1. Смеситель закреплен на стойке
2.Скорость вращения регулируется при помощи реостата 3. Значения определяется при помощи вольтметра. 4. Мощность потраченная на перемешивание определяется по формуле:
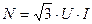 /3/
/3/
Здесь: U - напряжение, В;
I - сила тока, А.
Истинная мощность затраченная перемешивание определяется как разность мощностей при перемешивании жидкостей Nc и при пустом вращении Nn
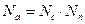 /4/
/4/
 Эксперименты надо провести при различных числах вращения и данные заносят в таблицу 1.
Эксперименты надо провести при различных числах вращения и данные заносят в таблицу 1.
Таблице I.
| Nc | |||||
| Nn | |||||
| Na |
Потом заполняется таблица 2.
Таблица 2.
| № | Название показателя | обозначение | измерение |
| Вид смесителя | |||
| Диаметр лопасти | α | м | |
| Диаметр посуды | Д | м | |
| Высота уровня жидкости | Н0 | м | |
| Ширина лопасти | в | м | |
| Число лопастей | z | м |
3. Обработка данных
Связь между критериями смесителей определяется по формуле /2/.Для определения С и m прологарифмируем уравнение /2/.
 lg Eu = lgC + mlgRe /5/
lg Eu = lgC + mlgRe /5/
Результаты заносим в таблицу 3.
| Eu | ||||
| Re | ||||
| Lg Eu | ||||
| Lg Re |
После чего строим график lg Eu и lg Re и определяем значение – m.
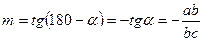 /6/
/6/
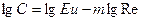 /7/
/7/
Анализируя полученные данные определяем мощность, затраченную на перемешивание.
 /8/
/8/
4. Контрольные вопросы.
1. Цель процесса перемешивания.
2. Как влияет коэффициент вязкости на величину затраченной энергии?
3. Почему в процессе обработки данных применяется система
логарифмических координат?
ЛАБОРАТОРНАЯ РАБОТА №9
|
|
|


