 |
52. Физико-химические свойства белков, растворимость, ионизация, гидратация, денатурация, ренатурация.
|
|
|
|
52. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА БЕЛКОВ, РАСТВОРИМОСТЬ, ИОНИЗАЦИЯ, ГИДРАТАЦИЯ, ДЕНАТУРАЦИЯ, РЕНАТУРАЦИЯ.
Индивидуальные белки различаются по своим физико-химическим свойствам: форме молекул, молекулярной массе, суммарному заряду молекулы, соотношению полярных и неполярных групп на поверхности нативной молекулы белка, растворимости белков, а также степени устойчивости к воздействию денатурирующих агентов.
Различия белков по молекулярной массе. Белки - высокомолекулярные соединения, но могут сильно отличаться по молекулярной массе, которая колеблется от 6000 до 1 000 000 Да и выше. Молекулярная масса белка зависит от количества аминокислотных остатков в полипептидной цепи, а для олигомерных белков - и от количества входящих в него протомеров (или субъединиц).
Различия белков по форме молекул. По форме молекул белки делят на глобулярные и фибриллярные. Глобулярные белки имеют более компактную структуру, их гидрофобные радикалы в большинстве своём спрятаны в гидрофобное ядро, и они значительно лучше растворимы в жидкостях организма, чем фибриллярные белки (исключение составляют мембранные белки).
Различия по р астворимости белков . Растворимость белков в воде зависит от формы, молекулярной массы, величины заряда, соотношения полярных и неполярных функциональных групп на поверхности белка. Кроме этого, растворимость белка определяется составом растворителя, т. е. наличием в растворе других растворённых веществ. Например, некоторые белки легче растворяются в слабом солевом растворе, чем в дистиллированной воде. С другой стороны, увеличение концентрации нейтральных солей может способствовать выпадению определённых белков в осадок. Денатурирующие агенты, присутствующие в растворе, также снижают растворимость белков.
|
|
|
Различия по гидратации. На поверхности большинства внутриклеточных белков преобладают полярные радикалы, однако соотношение полярных и неполярных групп отлично для разных индивидуальных белков. Так, протомеры олигомерных белков в области контактов друг с другом часто содержат гидрофобные радикалы. Поверхности белков, функционирующих в составе мембран или прикрепляющиеся к ним в процессе функционирования, также обогащены гидрофобными радикалами. Такие белки лучше растворимы в липидах, чем в воде.
Различия по ионизации. Белки имеют в своём составе радикалы лизина, аргинина, гистидина, глутаминовой и аспарагиновой кислот, содержащие функциональные группы, способные к ионизации (ионогенные группы). Кроме того, на N- и С-концах полипептидных цепей имеются α -амино- и α -карбоксильная группы, также способные к ионизации. Суммарный заряд белковой молекулы зависит от соотношения ионизированных анионных радикалов Глу и Асп и катионных радикалов Лиз, Apг и Гис. Значение рН, при котором белок приобретает суммарный нулевой заряд, называют " изоэлектрическая точка" и обозначают как pI. В изоэлектрической точке количество положительно и отрицательно заряженных групп белка одинаково, т. е. белок находится в изоэлектрическом состоянии. Так как большинство белков в клетке имеет в своём составе больше анионогенных групп (-СОО-), то изоэлектрическая точка этих белков лежит в слабокислой среде. Изоэлектрическая точка белков, в составе которых преобладают катионогенные группы, находится в щелочной среде. Наиболее яркий пример таких внутриклеточных белков, содержащих много аргинина и лизина, - гистоны, входящие в состав хроматина. Белки, имеющие суммарный положительный или отрицательный заряд, лучше растворимы, чем белки, находящиеся в изоэлектрической точке. Суммарный заряд увеличивает количество диполей воды, способных связываться с белковой молекулой, и препятствует контакту одноимённо заряженных молекул, в результате растворимость белков увеличивается. Заряженные белки могут двигаться в электрическом поле: анионные белки, имеющие отрицательный заряд, будут двигаться к положительно заряженному аноду (+), а катионные белки - к отрицательно заряженному катоду (- ). Белки, находящиеся в изоэлектрическом состоянии, не перемещаются в электрическом поле.
|
|
|
53/54/55. РАСТВОРЫ ВМС КАК ЛИОФИЛЬНЫЕ КОЛЛОИДНЫЕ РАСТВОРЫ, ОСОБЕННОСТИ ОБРАЗОВАНИЯ МИЦЕЛЛ, УСТОЙЧИВОСТЬ И РАЗРУШЕНИЕ РАСТВОРОВ ПОЛИМЕРОВ, ВЫСАЛИВАНИЕ И СОЛЮБЛИЗАЦИЯ. 54. ОСОБЕННОСТИ РАСТВОРОВ ВМС, НАБУХАНИЕ И РАСТВОРЕНИЕ, ЗАВИСИМОСТЬ ВЕЛИЧИНЫ НАБУХАНИЯ ОТ РАЗЛИЧНЫХ ФАКТОРОВ, ИЗОЭЛЕКТРИЧЕСКАЯ ТОЧКА БЕЛКОВ. 55. АНОМАЛЬНАЯ ВЯЗКОСТЬ РАСТВОРОВ ВМС, ВЯЗКОСТЬ КРОВИ И ДРУГИХ БИОЛОГИЧЕСКИХ ЖИДКОСТЕЙ, ОНКОТИЧЕСКОЕ ДАВЛЕНИЕ ПЛАЗМЫ И СЫВОРОТКИ КРОВИ.
Высаливание. Метод выделения белков, основанный на различиях в их растворимости при разной концентрации соли в растворе. Соли щелочных и щёлочно-земельных металлов вызывают обратимое осаждение белков, т. е. после их удаления белки вновь приобретают способность растворяться, сохраняя при этом свои нативные свойства.
Чаще всего для разделения белков методом высаливания используют разные концентрации солей сульфата аммония - (NH4)2SO4. Чем выше растворимость белка, тем большая концентрация соли необходима для его высаливания.
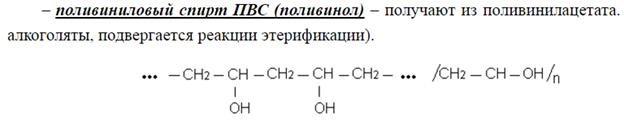
Молекулы ВМС имеют дифильный характер, так как содержат полярные (–COOH, –NH2, –OH и др. ) и неполярные (–CH3, –CH2, –C6H5) функциональные группы. Чем больше полярных радикалов в молекуле ВМС, тем лучше оно растворимо. Растворимость ВМС зависит от величины и формы их молекул.
СВОЙСТВА РАСТВОРОВ ВМС
(объединяющие их с истинными растворами)
1. Лекарственное вещество диспергировано до состояния молекул
2. При растворении ВМС растворы этих веществ образуются самопроизвольно
3. Растворы ВМС – гомогенные системы (нет границы раздела между растворяемым веществом и растворителем)
|
|
|
4. Растворы ВМС – термодинамически равновесные системы
5. Для растворов ВМС характерно:
– броуновское движение;
– отсутствие явления Тиндаля
СВОЙСТВА РАСТВОРОВ ВМС
(отличающие их от истинных)
1. Большой размер молекул
2. Низкое осмотическое давление
3. Малая диффузионная способность
4. Растворы ВМС не способны к диализу
5. Растворы ВМС могут изменяться под влиянием внешних факторов (добавление электролитов, изменение температуры и др. )
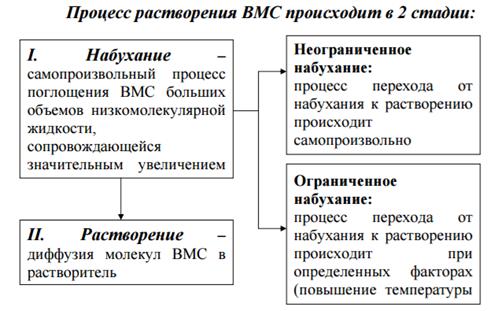
Коагуляция происходит в результате сжатия двойного электрического слоя и уменьшения или полного исчезновения электрического заряда, являющегося основным фактором устойчивости.
Высаливание – это уменьшение растворимости ВМС и выпадение в осадок.
Коацервация – раслаивание системы на два слоя.
Застудневание – особая промежуточная форма существования системы – студень или гель, причем, это состояние характеризуется полной утратой текучести.
Синерезис – явление застудневания, происходящее в самом студне, которое может привести к разделению системы на 2 фазы: концентрированный студень и растворитель, содержащий молекулы ВМС.
Коллоидные растворы представляют собой ультрамикрогетерогенную систему, в которой структурной единицей является комплекс молекул, атомов и ионов, называемых мицеллами. Мицелла является частицей дисперсной фазы, окруженная двойным электрическим слоем. Размер мицелл находится в пределах от 1 до 100 нм.
Строение мицеллы – ядро (отдельные молекулы гидрофобного вещества); гранула – адсорбционный слой ионов –противоионы (нейтрализуют гранулу) –диффузный слой ионов
|
|
|


