 |
56. Классификация сложных белков.
|
|
|
|
56. КЛАССИФИКАЦИЯ СЛОЖНЫХ БЕЛКОВ.
В зависимости от химической природы простетических групп среди сложных белков выделяют следующие классы:
Гликопротеиды, содержащие в качестве простетической группы ковалентно связанные углеводные остатки и их подкласс — протеогликаны, с мукополисахаридными простетическими группами. В образовании связи с углеводными остатками обычно участвуют гидроксильные группы серина или треонина. Большая часть внеклеточных белков, в частности, иммуноглобулины — гликопротеиды. В протеогликанах углеводная часть составляет ~95 %, они являются основным компонентом межклеточного матрикса.
Липопротеиды, содержащие в качестве простетической части нековалентно связанные липиды. Липопротеиды, образованные белками-аполипопротеинами связывающимися с ними липидами и выполняют функцию транспорта липидов.
Металлопротеины, содержащие негемовые координационно связанные ионы металлов. Среди металлопротеидов есть белки, выполняющие депонирующие и транспортные функции (например, железосодержащие ферритин и трансферрин) и ферменты (например, цинксодержащая карбоангидраза и различные супероксиддисмутазы, содержащие в качестве активных центров ионы меди, марганца, железа и других металлов)
Нуклеопротеины, содержащие нековалентно связанные ДНК или РНК, в частности, хроматин, из которого состоят хромосомы, является нуклеопротеидом.
Фосфопротеиды, содержащие в качестве простетической группы ковалентно связанные остатки фосфорной кислоты. В образовании сложноэфирной связи с фосфатом участвуют гидроксильные группы серина или треонина, фосфопротеинами являются, в частности, казеин молока:
|
|
|
Хромопротеиды — собирательное название сложных белков с окрашенными простетическими группами различной химической природы. К ним относится множество белков с металлсодержащей порфириновой простетической группой, выполняющие разнообразные функции — гемопротеины (белки, содержащие в качестве простетической группы гем — гемоглобин, цитохромы и др. ), хлорофиллы; флавопротеиды с флавиновой группой, и др.
57. ГЕМОПРОТЕИНЫ, СРАВНИТЕЛЬНАЯ ХАРАКТЕРИСТИКА СТРУКТУР И ФУНКЦИЙ МИОГЛОБИНА И ГЕМОГЛОБИНА.
Белки, соединённые с гемом, носят название гемопротеины.
Миоглобин. Состоит из одной полипептидной цепи, содержащей 153 аминокислотных остатка (мол. м. 17800), к-рая уложена в плотную глобулу размером 4, 5 х 2, 5 нм. В специальной полости миоглобина (" кармане" ) помещается гем, который связан с остальной частью молекулы (глобином), как в гемоглобине. Около 75% полипептидной цепи находится в конформации α -спирали (все α -спирали правозакрученные). Между областями спирализации находятся 5 неспирализованных участков; такие же участки находятся на концах цепи. Внутренняя область молекулы состоит. из неполярных остатков лейцина, валина, метионина, фенилаланина и не содержит боковых полярных цепей глутаминовой и аспарагиновой к-т, глута-мина, аспарагина, лизина и аргинина. На наружной стороне молекулы расположены как полярные, так и неполярные аминокислотные остатки. Атом железа тема может находиться в 4 состояниях: в ферросостоянии (дезоксимиоглобин, Fe2 +), в феррисостоянии (метмиоглобин, Fe3 +, 6-й лиганд Н2О) и в низкоспиновых ферро- и феррисостояниях (соответственно Fe2+ и Fe3+ ). Связывание лигандов сопровождается конформационными изменениями белка, и, наоборот, конформационные изменения вблизи гема изменяют его электронное состояние и реакционную способность. Функция миоглобина запасать О2 в мышцах при его избытке и освобождать при недостатке основана на способности иона Fe2+ обратимо связывать молекулу О2 с образованием оксимиоглобина. Высвобождение из оксимиоглобина молекулы О2, необходимого работающей мышце, происходит в момент сокращения последней, когда в результате сжатия капилляров парциальное давление О2 резко падает. Белок выполняет роль водорастворимого носителя гема, предохраняет Fe2+ от окисления при его взаимодействии с О2 и регулирует величину сродства к О2.
|
|
|
Кровь осуществляет дыхательную функцию прежде всего благодаря наличию в ней гемоглобина. Физиологическая функциягемоглобина как переносчика кислорода основана на способности обратимо связывать кислород. Поэтому в легочных капиллярах происходит насыщение крови кислородом, а в тканевых капиллярах, где парциальное давление кислорода резко снижено, осуществляется отдача кислорода тканям.
Гемоглобин человека содержит 0, 335% железа. Каждый грамм-атом железа (55, 84 г) в составе гемоглобина при полном насыщениикислородом связывает 1 грамм-молекулу кислорода (22400 мл). Таким образом, 100 г гемоглобина могут связывать
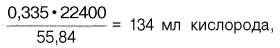
а каждый грамм гемоглобина – 1, 34 мл кислорода. Содержание гемоглобина в крови здорового человека составляет 13–16%, т. е. в 100 мл крови 13–16 г гемоглобина. При РО2 в артериальной крови 107–120 гПа гемоглобин насыщен кислородом на 96%. Следовательно, в этих условиях 100 мл крови содержит 19–20 об. % кислорода:

В венозной крови в состоянии покоя РО2 = 53, 3 гПа, и в этих условиях гемоглобин насыщен кислородом лишь на 70–72%, т. е. содержание кислорода в 100 мл венозной крови не превышает
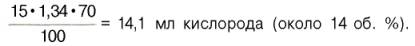
Артериовенозная разница по кислороду будет около 6 об. %. Таким образом, за 1 мин ткани в состоянии покоя получают 200–240 млкислорода (при условии, что минутный объем сердца в покое составляет 4 л). При взаимодействии молекулы кислорода с одним из четырех гемов гемоглобина кислород присоединяется к одной из половинокмолекулы гемоглобина (допустим, к α -цепи этой половинки). Как только такое присоединение произойдет, α -полипептидная цепь претерпевает конформа-ционные изменения, которые передаются на тесно связанную с ней β -цепь; последняя также подвергается конформационным сдвигам. β -Цепь присоединяет кислород, имея уже большее сродство к нему. Таким путем связывание одноймолекулы кислорода благоприятствует связыванию второй молекулы (так называемое кооперативное взаимодействие). После насыщения кислородом одной половины молекулы гемоглобина возникает новое, внутреннее, напряженное состояние молекулыгемоглобина, которое вынуждает и вторую половину гемоглобина изменить конфор-мацию. Теперь еще две молекулы кислорода, по-видимому, по очереди связываются со второй половинкой молекулы гемоглобина, образуя оксигемоглобин.
|
|
|
Организм располагает несколькими механизмами переноса СО2 от тканей к легким. Часть его переносится в физически растворенном виде. Растворимость СО2 в плазме крови в 40 раз превышает растворимость в ней кислорода, тем не менее при небольшой артериовенозной разнице РСО2 (напряжение СО2 в венозной крови, притекающей к легким по легочной артерии, равно 60 гПа, а в артериальной крови – 53, 3 гПа) в физически растворенном виде может быть перенесено в покое 12–15 мл СО2, что составляет 6–7% от всего количества переносимого углекислого газа. Некоторое количество СО2 может переноситься в виде карбаминовой формы. Оказалось, что СО2 может присоединяться к гемоглобинупосредством карбаминовой связи, образуя карбгемоглобин, или карбаминогемо-глобин
Карбгемоглобин – соединение очень нестойкое и чрезвычайно быстро диссоциирует в легочных капиллярах с отщеплением СО2. Количество карбаминовой формы невелико: в артериальной крови оно составляет 3 об. %, в венозной – 3, 8 об. %. В виде карбаминовой формы из ткани к легким переносится от 3 до 10% всего углекислого газа, поступающего из тканей в кровь. Основная масса СО2 транспортируется с кровью к легким в форме бикарбоната, при этом важнейшую роль играет гемоглобин эритроцитов.
Гемоглобин F — это белок-гетеротетрамер из двух α -цепей и двух γ -цепей глобина, или гемоглобин α 2γ 2. Этот вариант гемоглобина есть и в крови взрослого человека, но в норме он составляет менее 1 % от общего количества гемоглобина крови взрослого и определяется в 1-7 % от общего числа эритроцитов крови. Однако у плода эта форма гемоглобина является доминирующей, основной. Гемоглобин F обладает повышенным сродством к кислороду и позволяет сравнительно малому объёму крови плода выполнять кислородоснабжающие функции более эффективно. Однако гемоглобин F обладает меньшей стойкостью к разрушению и меньшей стабильностью в физиологически широком интервале pH и температур. В течение последнего триместра беременности и вскоре после рождения ребёнка гемоглобин F постепенно — в течение первых нескольких недель или месяцев жизни, параллельно увеличению объёма крови — замещается «взрослым» гемоглобином А (HbA), менее активным транспортёром кислорода, но более стойким к разрушению и более стабильным при различных значениях pH крови и температуры тела. Такое замещение происходит вследствие постепенного снижения продукции γ -цепей глобина и постепенного увеличения синтеза β -цепей созревающими эритроцитами. Повышенное сродство к кислороду HbF определяется его первичной структурой: в γ -цепях вместо лизина-143 (β -143 лизин у HbA находится серин-143, вносящий дополнительный отрицательный заряд. В связи с этим молекула HbA менее положительно заряжена и основной конкурент за связь гемоглобина с кислородом − 2, 3ДФГ (2, 3-дифосфоглицерат) — в меньшей степени связывается с гемоглобином, в этих условиях кислород получает приоритет и связывается с гемоглобином в большей степени
|
|
|
|
|
|


