 |
Элементы химической термодинамики
|
|
|
|
Термодинамика – это наука, изучающая взаимные превращения различных видов энергии, связанные с переходом энергии в форме теплоты и работы.
Основным источником энергии для организма человека является химическая энергия, заключенная в пищевых продуктах, часть которой (за вычетом энергии, выводимой из организма с продуктами жизнедеятельности) расходуется на:
1) совершение работы внутри организма, связанной с дыханием, кровообращением и т.д.;
2) нагревание вдыхаемого воздуха, потребляемой воды и пищи;
3) покрытие потерь теплоты в окружающую среду с выдыхаемым воздухом и с продуктами жизнедеятельности и т.д.
Химическая энергия также расходуется на совершение внешней работы, связанной с перемещениями человека, его трудовой деятельностью и т.д.
Белки, жиры и углеводы служат субстратами окислительного фосфорилирования – одного из важнейших компонентов клеточного дыхания, приводящего к получению энергии в виде АТФ.
Энергетический обмен в клетке в основном связан с расщеплением макроэргических связей АТФ. Энергия АТФ используется, например, для биосинтеза белка.
Молекулы пищевых веществ служат материалом для построения всех клеток нашего организма. В тоже время молекулы пищи «сгорают» внутри нас и снабжают организм энергией, необходимой для поддержания его постоянной температуры, физической и мысленной деятельности.
Энергию дает практически любая пища, но углеводы (сахар и крахмал) содержат ее больше других продуктов. Чтобы успешно строить клетки нашего организма, нужны более специфические вещества. Основной строительный материал в этом случае – белки и жиры. Также абсолютно необходимы витамины и минеральные соли, хотя и в очень небольших количествах.
|
|
|
Калория – это единица измерения количества энергии, в том числе и в продуктах питания. Например, порция жареной в масле картошки содержит 220 ккал. Откуда берется эта энергия? Ответ прост. Вся энергия пищи – это сохраненная энергия солнечного света.
При фотосинтезе растения поглощают солнечную энергию и синтезируют из простых молекул большие, богатые энергией молекулы.
6СО2 + 6Н2О + 686 ккал = С6Н12О6 + 6О2
Энергия Солнца переходит в химическую энергию молекул. При попадании в организм они окисляются с выделением энергии. Так, в конечном итоге мы используем энергию Солнца.
Термохимия
Раздел термодинамики, изучающий превращение энергии при протекании химических процессов, называется химической термодинамикой, или термохимией.
В термохимии уравнения химических реакций называются термохимическими. Для них характерны:
- эти уравнения записывают с учетом термодинамических функций состояния системы;
- учитывается 1 моль вещества, поэтому возможны дробные коэффициенты;
- в термохимических уравнениях указывается агрегатное состояние веществ;
- с термохимическими уравнениями можно производить обычные алгебраические действия. Например,
1/2N2(г) + 1/2О2(г) = NО(г), ΔН>0
Понятие о коэффициенте калорийности пищи. Коэффициенты калорийности основных компонентов пищи: белков, жиров и углеводов.
Закон Гесса и его следствия находят практическое применение в медицине. С их помощью оценивается калорийность пищевых продуктов.
Коэффициентом калорийности называют энтальпию сгорания 1 г вещества, взятую с обратным знаком. Выражается в кДж/г или ккал/г (1кал = 4,18Дж).
Основными компонентами пищи являются белки, жиры и углеводы.
Коэффициенты калорийности:
- белков 16,5 – 17,2 кДж/г;
- углеводов 16,5 – 17,2 кДж/г;
- жиров 37,7 – 39,8 кДж/г.
Для расчета калорийности порции пищи, содержащей белки (mб), углеводы (mу) и жиры (mж) используют формулу:
|
|
|
Кmin = (mб · 16,5 + mу · 16,5 + mж · 37,7) кДж
Кmax = (mб · 17,2 + mу · 17,2 + mж · 39,8) кДж
На основании данных по калорийности пищевых продуктов составляются научно-обоснованные нормы потребления пищевых веществ для различных групп населения в зависимости от пола, возраста, характера труда. Пользуясь этими величинами, как средними данными врач составляет нормы потребления пищевых веществ каждого пациента в отдельности.
Контрольные вопросы
1. Термодинамика. Основные понятия и термины. Система. Фаза. Классификация систем. Термодинамические параметры. Стандартные термодинамические параметры.
2. Термодинамические функции состояния системы. Внутренняя энергия. Первый закон термодинамики, формулировка, математическое выражение, философское значение, применение к биологическим системам.
3. Термодинамические функции состояния системы. Энтальпия. Энтропия. Энергия Гиббса. Химический потенциал.
4. Термохимия. Термохимические уравнения, их особенности. Закон Гесса. Энтальпии образования и сгорания. Стандартные энтальпии образования и сгорания. Следствия из закона Гесса, формулировки, математические выражения, примеры.
5. Понятие о коэффициенте калорийности пищи. Коэффициенты калорийности основных компонентов пищи: белков, жиров и углеводов.
Типовые задачи
Задача 1. Рассчитать калорийность булки хлеба «Бородинский» массой 450 г, если его стограммовый кусочек содержит 7,4 г белков, 57,1 г углеводов и 1,2 г жиров. Коэффициенты калорийности брать по нижней границе.
Решение
1. Найти массы белков (mб), углеводов (mу) и жиров (mж) в 450 г хлеба «Бородинский»:
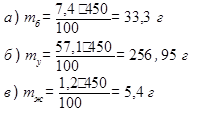 |
2. Рассчитать калорийность булки хлеба «Бородинский» массой 450 г:
К = (mб ·16,5 + mу · 16,5 + mж · 37,7) кДж
К = 33,3 · 16,5 + 256,95 · 16,5 + 5,4 · 37,7 = 4992,705 кДж
Ответ: К = 4992,705 кДж.
Задача 2. Определить изменение энтальпии химической реакции:
2С2Н5ОН(ж) → С2Н5-О-С2Н5(ж) + Н2О(ж), используя следующие данные:
DН0сгор С2Н5ОН(ж) = –1370,00 кДж·моль-1
DН0сгор С2Н5ОС2Н(ж) = –2720,04 кДж·моль-1
DН0сгор Н2О(ж) = 0 кДж·моль-1
Решение:
Поскольку даны энтальпии сгорания реагентов и продуктов, то используя 2-ое следствие из закона Гесса запишем:
DН0р-я = SDН0сгор. реагентов – SDН0сгор. продуктов
|
|
|
Применительно к этой реакции:
DН0р-я = 2DН0сгорС2Н5ОН(ж) – DН0сгорС2Н5ОС2Н5(ж) = 2 · (–1370,00) – (–2720,04) = 2740,00 + 2720,04 = –19,96 кДж·моль-1.
Ответ: DН0р-я = –19,96 кДж·моль-1.
Задача 3. Определить стандартную энтальпию образования оксида меди (II) CuO(к), используя следующие данные:
1) 3CuO(к) + 2NH3(г) = 3Cu(к) + N2(г) + 3H2O(ж), DH10 = –299,53 кДж·моль-1
2) 1/2N2(г) + 3/2H2(г) = NH3(г), DH20 = –46,19 кДж·моль-1
3) H2(г) + 1/2О2(г) = H2О(ж), DH30 = –285,838 кДж·моль-1
Решение:
Поскольку необходимо определить стандартную энтальпию образования оксида меди (II), то используя I-ое следствие из закона Гесса запишем:
DН0р-я = SDН0обр. продуктов – SDН0обр. реагентов
Применительно к 1-ой реакции:
DН0р-я = 3DН0обрCu(к) + DН0обрN2(г) + 3DН0обрН2О(ж) – (3DН0обрCuО(к) – 2DН0обрNH3(г)).
Учитывая, что в термохимии энтальпии образования простых веществ азота N2(г) и меди Cu(к) приняты равными нулю и раскрыв скобки, получаем следующее уравнение:
DН0р-я = 3DН0обрН2О(ж) – 3DН0обрCuО(к) – 2DН0обрNH3(г).
Переносим в левую часть уравнения DН0обрCuО(к) с обратным знаком и получаем:
 |
 |
Подставим числовые значения указанных параметров:
Ответ: DН0обр CuО(к) = - 155,20 кДж·моль-1.
Задача 4. Рассчитать величину стандартного изобарно-изотермического потенциала для следующей реакции: 2C4H10(г) + 5О2(г) → 4CH3COOH(ж) + 2Н2О(ж), используя следующие данные:
DН0р-я = –2267,94 кДж·моль-1
DS0р-я = –866,30 Дж·моль-1
Решение:
Поскольку даны значения энтальпийного и энтропийного факторов, то для расчета стандартного изобарно-изотермического потенциала используем следующее уравнение:
DG0р-я = DН0 – Т·DS0
Прежде, чем подставить в это уравнение значения указанных параметров, необходимо перевести величину энтропийного фактора в кДж·моль-1. Это будет составлять –0,866 кДж·моль-1.
Подставляем цифровые значения указанных величин в приведенное уравнение. При этом учитываем, что стандартная температура составляет 298 К:
DG0р-я= –2267,94 – 298 · (–0,866) = –2009,872 кДж·моль-1
Ответ: DG0р-я= –2009,872 кДж·моль-1
|
|
|


