 |
Эквиваленты и молярные массы эквивалентов.
|
|
|
|
Закон постоянства состава.
Согласно этому закону каждое химически чистое соединение всегда имеет один и тот же количественный состав независимо от способа его получения. Этот закон появился в результате длительного (1801-1808) спора французских химиков Ж.Пруста, считавшего, что отношения между элементами, образующими соединения, должны быть постоянными, и К.Бертолле, который считал, что состав химических соединений является переменным. В результате тщательной экспериментальной проверки восторжествовала точка зрения Пруста, считавшего состав соединений постоянным. Закон постоянства состава сыграл важную роль в развитии химии и до сих пор сохранил свое значение, однако выяснилось, что не все соединения имеют постоянный состав. В 1912-1913 гг Н.С. Курнаков установил, что существуют соединения переменного состава, которые он предложил назвать бертоллидами. К бертоллидам относятся многие кристаллические соединения: оксиды, карбиды, нитриды, фосфиды и т.д. Например, в зависимости от способа получения состав оксида титана может изменяться от ТiO0,6 до TiO1,33. Соединения постоянного состава по предложению Н.С.Курнакова называют дальтонидами. К дальтонидам относятся газообразные, жидкие и часть твердых веществ, имеющих молекулярное строение, т.е. состоящих из молекул. В состав молекул входит лишь целое и притом постоянное количество атомов. Число атомов в молекуле выражается целочисленными индексами в химических формулах, например,  и т.п. Отношение между массами элементов в соединениях постоянного состава всегда постоянно, т.к. атомы обладают определенной массой.
и т.п. Отношение между массами элементов в соединениях постоянного состава всегда постоянно, т.к. атомы обладают определенной массой.
Газовые законы:
- Бойля - Мариотта при постоянной температуре t°, давление, производимое данной массой газа, обратно пропорционально объему газа:
|
|
|
, при t° = const.
- Гей - Люссака при постоянном давлении объем газа изменяется прямо пропорционально абсолютной температуре:
, при P = const.
- Шарля: при постоянном объеме давление газа изменяется прямо пропорционально абсолютной температуре.
, при V = const.
- Объединенный закон Бойля - Мариотта, Гей - Люссака и Шарля:
, при V = const.
Закон эквивалентов: (открыт в конце XVIII в.) - вещества взаимодействуют между собой в количествах, пропорциональных их химическим эквивалентам.
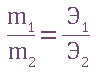 , при t° = const.
, при t° = const.
Химический эквивалент - это масса элемента (выраженная в углеродных единицах), которая присоединяет или замещает одну атомную массу водорода или половину атомной массы кислорода.
Химический эквивалент кислоты равен её молярной массе, деленной на основность (число ионов водорода) кислоты.
Химический эквивалент основания равен его молярной массе, деленной на кислотность (число гидроксильных групп) основания.
Химический эквивалент соли равен её молярной массе, деленной на сумму зарядов образующих её катионов или анионов.
Закон Дальтона (закон парциальных давлений).
Парциальным давлением (po) газа в смеси называется давление, которое производил бы этот газ, занимая при тех же физических условиях объем всей газовой смеси.
Согласно закону: общее давление смеси газов, не вступающих друг с другом в химическое взаимодействие, равно сумме парциальных давлений газов, составляющих смесь.

4.Понятие об эквиваленте. Закон эквивалентов. Расчеты эквивалентов простых и сложных веществ.
Эквиваленты и молярные массы эквивалентов.
| Элемент или сложное вещество | Эквивалент, Э, [ -] | Молярная масса(М экв.)эквивалента,[г/моль] |
| Элемент Например, Са | Ээл = 1∙ f =1/В Э (Ca) = 1/2 | Мэкв = M ∙ f = M /В М(½Ca) = 40/2 = = 20 г/моль |
| Кислота Например, H2S | Э кислоты = 1∙ f = = 1/основность Э кислоты = 1∙ f = =1/основность | Мэкв = M ∙ f = M / основность М(½Н2S).=34 ∙ 1/2 = = 17 г/моль |
| Основание Например, Са(OH)2 | Эосн = 1 ∙ f = = 1/кислотность Э [Ca(OH)2] = 1/2 | Мэкв = M ∙ f = = M/кислотность М[½Ca(OH)2] = = 74 / 2 = 37 г/моль |
| Соль Например, Al2S3 | Эсоли = 1∙ f = 1 / n ∙ В = = Э [Al2S3] = 1/2 ∙ 3 = 1/6 | Мэкв = M ∙ f = = M / n ∙ В М(1/6 Al2S3) = = 150 / 6 = 25 г/моль |
Эквивалент и молярная масса эквивалента сложного вещества определяются конкретной реакцией, в которой участвует данное вещество.
|
|
|
|
|
|


