 |
Основные понятия термодинамики
|
|
|
|
Термодинамическая система – тело или группа тел, находящихся во взаимодействии, мысленно или реально обособленные от окружающей среды.
Гомогенная система – система, внутри которой нет поверхностей, разделяющих отличающиеся по свойствам части системы (фазы).
Гетерогенная система – система, внутри которой присутствуют поверхности, разделяющие отличающиеся по свойствам части системы.
Фаза - совокупность гомогенных частей гетерогенной системы, одинаковых по физическим и химическим свойствам, отделённая от других частей системы видимыми поверхностями раздела.
Изолированная система - система, которая не обменивается с окружающей средой ни веществом, ни энергией.
Закрытая система – система, которая обменивается с окружающей средой энергией, но не обменивается веществом.
Открытая система – система, которая обменивается с окружающей средой и веществом, и энергией.
Совокупность всех физических и химических свойств системы характеризует её термодинамическое состояние. Все величины, характеризующиекакое-либомакроскопическое свойство рассматриваемой системы – параметры состояния.
Опытным путем установлено, что для однозначной характеристики данной системы необходимо использовать некоторое число параметров, называемых независимыми;
все остальные параметры рассматриваются как функции независимых параметров. В качестве независимых параметров состояния обычно выбирают параметры, поддающиеся непосредственному измерению, например температуру, давление,
концентрацию и т.д. Всякое изменение термодинамического состояния системы (изменения хотя бы одного параметра состояния) есть термодинамический процесс.
|
|
|
Обратимый процесс – процесс, допускающий возможность возвращения системы в исходное состояние без того, чтобы в окружающей среде остались какие-
либо изменения.
Равновесный процесс – процесс, при котором система проходит через
непрерывный ряд равновесных состояний.
Энергия - мера способности системы совершать работу; общая качественная
мера движения и взаимодействия материи. Энергия является неотъемлемым
свойством материи. Различают потенциальную энергию, обусловленную положением тела в поле некоторых сил, и кинетическую энергию, обусловленную изменением положения тела в пространстве.
Внутренняя энергия системы - сумма кинетической и потенциальной энергии
всех частиц, составляющих систему. Можно также определить внутреннюю энергию
системы как её полную энергию за вычетом кинетической и потенциальной энергии системы как целого.
8. Термодинамические функции. Законы термодинамики.
Первый закон термодинамики (первое начало термодинамики) Пусть DQ - полное количество тепла, поглощенное системой при произвольном термодинамическом процессе, а DW - полная работа, проделанная при этом системой. Первый закон термодинамики гласит, что величина DU, определяемая равенством DU = DQ - DW, (4) одинакова для всех процессов, в результате которых система переходит из данного начального в данное конечное состояние. Это позволяет определить функцию состояния U, называемую внутренней энергией. Из эксперимента известно, что внутренняя энергия является экстенсивной величиной. Для процессов с бесконечно малым изменением термодинамических параметров первый закон утверждает, что дифференциал dU = dQ - dW (5) является полным. Это означат, что существует функция U, дифференциал которой равен dU, или интеграл ò dU не зависит от пути интегрирования, а определяется лишь пределами интегрирования. Этим свойством, очевидно, не обладают приращения dQ и dW. Чтобы из общих термодинамических соотношений получать конкретные результаты, нужно знать внутреннюю энергию системы как функцию параметров, определяющих ее состояние, U = U(V,T). Зависимость называется калорическим уравнением состояния. Соотношение – называется термическим уравнением состояния Следствие первого закона термодинамики – закон Гесса: Тепловой эффект реакции зависит лишь от природы и физического состояния исходных веществ и конечных продуктов и не зависит от промежуточных стадий реакции. Второй закон термодинамики (второе начало термодинамики) Постулаты Кельвина и Клаузиуса. Формулировка Кельвина. Не существует такого термодинамического процесса, единственным результатом которого было бы превращение некоторого количества тепла, полученного из термостата, целиком в работу. Формулировка Клаузиуса. Не существует такого термодинамического процесса, единственным результатом которого была бы передача некоторого количества тепла, полученного от менее нагретого тела, более нагретому телу.
|
|
|
Третий закон термодинамики (третье начало термодинамики) Энтропия любой системы при абсолютном нуле температуры является универсальной постоянной, которую можно положить равной нулю.

9. Химическая кинетика. Предмет, возможности и основные понятия химической кинетики. Понятие скорости реакции.
Кинетика - это раздел химии, изучающий скорость, механизм химических реакций и влияние на них различных факторов. С исследованиями кинетики химических реакций связаны важнейшие направления современной химии и химической промышленности: разработка рациональных принципов управления химическими процессами; стимулирование полезных, торможение и подавление нежелательных химических реакций; создание новых и усовершенствование существующих процессов и аппаратов в химической технологии; изучение поведения химических продуктов, материалов и изделий из них в различных условиях применения и эксплуатации.
Основные понятия химической кинетики
Система- совокупность находящихся во взаимодействии веществ, мысленно (или фактически) обособленная от окружающей среды.
Фаза- это часть системы, однородная во всех точках по составу и свойствам и отделённая от других частей системы поверхностью раздела, Вещество может находиться в трёх фазах: жидкой, твёрдой и газообразной.
|
|
|
В зависимости от количества фаз все системы и реакции в них делят на гомогенные и гетерогенные.
Гомогенные реакции протекают в одной фазе (как правило- газовой). Например, реакция взаимодействия между хлором и водородом, приводящая к образованию хлороводорода (однофазная система): Cl2 + H2=2HCl
Гетерогенные реакции протекают на поверхности раздела фаз. Примерам гетерогеннойреакции может служить реакция горения, протекающая на границе уголь-кислород (система, состоящая из двух фаз): С + О2=СО2: При 0 °С лед, вода и находящийся над ними пар образуют гетерогенную систему из трех фаз: твердой — льда, жидкой — воды и газообразной — водяного пара.
Молекулярность реакции определяется числом молекул, участвующих в самой медленной, лимитирующей стадии. Реакции бывают моно-, би-, три- и т.д. молекулярными. Мономолекулярной называется такая реакция, в которой лимитирующей стадией является превращение одной молекулы, например распад ее на составляющие (диссоциация молекул иода I2 = 2I) или превращение в другую молекулу в результате внутримолекулярной перестройки:


Бимолекулярная реакция – это взаимодействие двух молекул (например, молекулярного водорода с молекулярным иодом, H2 + I2 = 2HI). Реакция, протекающая одновременно с участием трех молекул, называется тримолекулярной. Поскольку вероятность столкновения сразу трех молекул, да еще в правильной взаимной ориентации, очень мала, такие реакции происходят редко.
Порядок реакции. Порядок реакции – это эмпирическая величина, равная сумме показателей степеней, с которыми концентрации реагентов входят в выражение для скорости реакции. Так, для реакции
a A + b B = m M + n N
Порядок реакции в этом случае равен а + b.
Реакции первого порядка- это реакции, в которых скорость зависит от концентрации только одного реагента в первой степени. Уравнению первого порядка следуют многие химические реакции. Например, С2Н5ОН = С2Н4 + Н2О
|
|
|
Реакции второго порядка– это реакция, в которой скорость пропорциональна квадрату концентрации отдельного реагента или концентрациям каждого из двух реагирующих веществ в первой степени. Например: 1) 2НВr = Н2 + Вr2 или 2) CH3Br + KOH = CH3OH + KBr
Реакции третьего порядка это реакция, в которой скорость может зависеть от концентрации одного реагента в третьей степени, либо концентрации одного реагента во второй степени и второго реагента в первой степени, либо от концентрации каждого из трех реагентов в первой степени.
Исследования кинетики различных взаимодействий показывают, что чаще других встречаются реакции 1-го, 2-го и иногда третьего порядков. Но существуют реакции и других порядков.
Реакции нулевого порядка- это реакция, в которой скорость не зависит от концентраций реагентов и определяется другими лимитирующими факторами, например площадью поверхности катализатора (в реакциях гетерогенного катализа) или поглощением света (в фотохимических реакциях).
Как правило, для большинства простых реакций порядок реакции и её молекулярность совпадают и определяются вышеописанными способами. Но для реакций, протекающих в несколько стадий, порядок реакции определяется экспериментально или на основании сложных математических расчётов.
Основным понятием в химической кинетике является, понятие о скорости реакции.
Одни реакции протекают практически мгновенно (например, нейтрализация кислоты основанием), другие при обычных условиях идут настолько медленно, что заметные изменения концентраций реагентов наблюдаются лишь через несколько лет (например, взаимодействие водорода с кислородом с образованием воды в отсутствие катализатора). При этом существует множество реакций, протекающих с вполне измеримыми скоростями в обычных условиях. Химическая кинетика занимается определением скоростей химических реакций и изучением их механизма.
Скорость химической реакции
Скорость химической реакции определяется количеством вещества, прореагировавшего в единицу времени (вступившего в реакцию или образовавшегося в результате реакции) в единице объема системы (для гомогенной р-и) или на единице площади поверхности раздела фаз (для гетерогенной реакции).
 С(концентрация)
С(концентрация)

 2
2
 время
время
Где 1 -изменение концентрации исходного вещества; 2 - изменение концентрации продукта реакции
Из этого графика следует, что при химическом взаимодействии концентрация каждого из исходных веществ уменьшается во времени (С2<C1;  C<0), а концентрация продуктов реакции увеличивается (C2>C1, С>0).
C<0), а концентрация продуктов реакции увеличивается (C2>C1, С>0).
|
|
|
В химической кинетике различают среднюю и истинную (мгновенную) скорость.
10) Скорость гомогенных и гетерогенных химических реакций. Основные факторы, влияющие на скорость.

Факторы:
- природа реагирующих веществ,
- концентрация реагентов,
- температура,
- наличие катализатора.
11.Влияние концентрации реагирующих веществ на скорость реакции. Закон действия масс, константа скорости реакции. Молекулярность и порядок реакции.

Закон действия масс:
Скорость химической реакции в каждый момент времени пропорциональна концентрациям реагентов, возведенным в некоторые степени:
v = k[A]n[B]m, для реакции aA + bB =...
Молекулярность реакции – это минимальное число молекул, участвующих в элементарном химическом процессе. По молекулярности элементарные химические реакции делятся на молекулярные (А →) и бимолекулярные (А + В →); тримолекулярные реакции встречаются чрезвычайно редко.
Если реакция протекает последовательно через несколько гомогенных или гетерогенных элементарных стадий, то суммарная скорость всего процесса определяется самой медленной его частью, а молекулярность заменяется порядком реакции – формальным показателем при концентрации реагирующих веществ. Поэтому весь процесс в целом лучше характеризует порядок реакции.
Порядок реакции по данному веществу — показатель степени при концентрации этого вещества в кинетическом уравнении реакции.
Для элементарных реакций порядок реакции - целочисленная величина, совпадающая с молекулярностью реакции. Для всех других (не элементарных, сложных) реакций их порядки МОЖНО ОПРЕДЕЛИТЬ ТОЛЬКО ЭКСПЕРИМЕНТАЛЬНО. Причем они могут иметь как целочисленные, так и дробные и (даже нулевое!) значение. В реальных кинетических исследованиях редко встречается порядок реакции выше третьего.
12.Влияние температуры на скорость химической реакции. Правило Вант-Гоффа, уравнение Аррениуса. Энергия активации химической реакции.
Энергия активации— минимальное количество энергии, которое требуется сообщить системе (выражается в джоулях на моль), чтобы произошла реакция.


13. Химическое равновесие в гомогенных системах. Константа равновесия. Факторы, влияющие на химическое равновесие. Принцип Ле-Шателье
Гомогенная термодинамическая система-система, состоящая из одной фазы
Фаза-часть системы, однородная во всех точках по составу и свойствам и отдалённая от других частей системы
Химическое равновесие состояние химической системы, при котором количество исходных веществ и продуктов не меняются со временем
Константа равновесия определяется экспериментально. Численное значение Кр характеризует положение равновесия при данной температуре и не меняется с изменением концентраций реагирующих веществ.
Факторы, влияющие на химическое равновесие:
1) температура
При увеличении температуры химическое равновесие смещается в сторону эндотермической (поглощение) реакции, а при понижении — в сторону экзотермической (выделение) реакции.
2) давление
При повышении давления химическое равновесие смещается в сторону меньшего объёма веществ, а при понижении — в сторону большего объёма. Этот принцип действует только на газы, т. е. если в реакции участвуют твёрдые вещества, то они в расчёт не берутся.
3) концентрация исходных веществ и продуктов реакции
При увеличении концентрации одного из исходных веществ химическое равновесие смещается в сторону продуктов реакции, а при понижении концентрации — в сторону исходных веществ.
При́нцип Ле Шателье́ если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо из условий равновесия (температура, давление, концентрация, внешнее электромагнитное поле), то в системе усиливаются процессы, направленные на компенсацию внешнего воздействия.
14.Растворы, растворение. Общие понятия и представления о растворах и растворении. Количественные характеристики растворов.
Раствор-гомогенная многокомпонентная хим система переменного состава с относительно постоянными свойствами, состоящий из растворителя и растворённых веществ
Растворение-сложный физико-химический процесс, сопровождающийся фазовым переходом и сальватацией
Растворы-твёрдые,жидкие,газообразные
Растворы:
-ненасыщенные – в р-ре не достигнут предел растворимости и возможно дальнейшее растворение
-насыщенные-в р-ре достигнут предел растворимости и дальнейшее добавление в-ва приводит к его отделению от р-ра
-перенасысыщенный- в р-ре при определённых условиях устанавливается концентрация вещества превышаюшая предел растворимости, при этом не происходит отделения избытка в-ва от р-ра, р-р термодинамически не зависит (дельта G>0)
1) массовая доля растворённого вещества, которая равна отношению массы растворённого вещества к массе раствора; 2) молярная концентрация, показывающая число молей растворённого вещества в 1 литре раствора. Или водородный показатель, массовая доля, молярная концентрация
15. Коллигативные свойства растворов. Законы Ф. Рауля, У. Генри, Я. Вант-Гоффа
Свойства р-ра, зависящие только от концентрации растворённых веществ, не зависит от его природы
з. Рауля – давление насыщенного пара над раствором ниже, чем над чистым растворителем
Следствия из закона Рауля: взять из тетради
З.Генри- растворимость газа в жидкостях пропорциональна давлению (формулы)
З. Вант - Гоффа -зависимость скорости протекания химической реакции от температуры
16.Электролиты. Коллигативные свойства растворов электролитов. Электролитическая диссоциация: степень диссоциации, сила электролита, обратимая диссоциация, константа диссоциации.
Электроли́т — вещество растворы или расплавы которого проводят ток благодаря наличию заряженных частиц - ионов
Коллигативные свойства растворов — это свойства растворов, обусловленные только самопроизвольным движением молекул, то есть они определяются не химическим составом, а числом кинетических единиц — молекул в единице объёма или массы[1]. К таким коллигативным свойствам относятся:
· Понижение давления насыщенного пара,
· Повышение температуры кипения растворов,
· Понижение температуры замерзания растворов,
· Возникновение осмотического давления.
Электролитическая диссоциация — процесс распада электролита на ионы при его растворении или плавлении.
Степень диссоциации — величина, характеризующая состояние равновесия в реакции диссоциации в гомогенных (однородных) системах.
Сила электролитов Согласно теории электролитической диссоциации, соли, кислоты, гидроксиды, растворяясь в воде, полностью или частично распадаются на самостоятельные частицы – ионы. Процесс распада молекул веществ на ионы под действием полярных молекул растворителя называют электролитической диссоциацией.
Константа диссоциации — в растворах слабых электролитах устанавливает равновесие между молекулярной и ионной формами
Обратимая диссоциация-
17.Электролиты: ступенчатая диссоциация, закон разбавления В. Оствальда и следствия из него.
Многоосновные кислоты и основания подвергаются диссоциации ступенчато. Каждая степерь характеризуется своим значением Кд. В большинстве случаев диссоциация протекает только по первой степени

18.Диссоциация воды. Ионное произведение воды. Кислотность и щелочность среды, водородный показатель. Кислотно-основные индикаторы.
Константа Kв, равная произведению концентраций протонов и гидроксид-ионов, называется ионным произведением воды. Она является постоянной не только для чистой воды, но также и для разбавленных водных растворов веществ. C повышением температуры диссоциация воды увеличивается, следовательно, растёт и Kв, при понижении температуры — наоборот.

Растворы, в которых концентрации ионов Н+ и ОН– одинаковы, называются нейтральными растворами. В кислых растворах больше содержится ионов водорода, а в щелочных – гидроксид-ионов. Но какова бы ни была реакция среды в растворе, произведение молярных концентраций ионов Н+и ОН–останется постоянным.
нейтральный раствор ® 
кислый раствор ® 
щелочной раствор ® 
На практике для количественной характеристики кислотности или щёлочности раствора используют не молярную концентрацию в нём ионов Н+, а её отрицательный десятичный логарифм. Эта величина называется водородным показателем и обозначается через рН:
рН = –lg[H+]
Например, если  , то рН = 2; если
, то рН = 2; если  , то рН = 10. В нейтральном растворе рН = 7. В кислых растворах рН < 7 (и тем меньше, чем «кислее» раствор, т.е. чем больше в нём концентрация ионов Н+). В щёлочных растворах рН > 7 (и тем больше, чем «щелочнее» раствор, т.е. чем меньше в нём концентрация ионов Н+).
, то рН = 10. В нейтральном растворе рН = 7. В кислых растворах рН < 7 (и тем меньше, чем «кислее» раствор, т.е. чем больше в нём концентрация ионов Н+). В щёлочных растворах рН > 7 (и тем больше, чем «щелочнее» раствор, т.е. чем меньше в нём концентрация ионов Н+).
Для измерения рН раствора существуют различные методы. Очень удобно приблизительно оценивать реакцию раствора с помощью специальных реактивов, называемых кислотно-основными индикаторами. Окраска этих веществ в растворе меняется в зависимости от концентрации в нём ионов Н+. Характеристика некоторых наиболее распространённых индикаторов представлена в таблице 12.
Таблица 12. Важнейшие кислотно-основные индикаторы
| Название индикатора | Цвет индикатора в различных средах | ||
| в кислой | в нейтральной | в щелочной | |
| Метиловый красный | красный рН < 4,2 | оранжевый 4,2 < рН< 6,3 | жёлтый рН >6,3 |
| Фенолфталеин | бесцветный рН <7 | бесцветный 7 < pH < 8 | малиновый рН >8 |
| Лакмус | красный рН < 5 | фиолетовый 5< pH < 8 | синий рН > 8 |
19).Буферные системы. Понятие, классификация и механизм действия.
Растворы, способные сохранять постоянной концентрацию ионов Н+ при добавлении к ним небольших количеств сильной кислоты или щелочи, а также при разбавлении, называются буферными растворами или буферными системами.
Классификация буферных систем
1. Кислотные. Состоят из слабой кислоты и соли этой кислоты. Например, ацетатная буферная система (CH3COOH+ СН3СООNa), гидрокарбонатная буферная система (H2CO3 +NaHCO3).
2. Основные. Состоят из слабого основания и его соли. Например, аммиачная буферная система (NH3H×2O + NH4Cl).
3. Солевые. Состоят из кислой и средней соли или двух кислых солей. Например, карбонатная буферная система (NaHCO3+Na2CO3), фосфатная буферная система (КН2PO4 + К2НPO4).
4. Аминокислотные и белковые. Если суммарный заряд молекулы аминокислоты или белка равен нулю (изоэлектрическое состояние), то растворы этих соединений не являются буферными. Их буферное действие начинает проявляться тогда, когда к ним добавляют некоторое количество кислоты или щелочи.
1.Разбавление. При разбавлении водой концентрации кислоты и соли уменьшаются в одно и то же число раз, но соотношение lg С(соли)/С(кислоты) не меняется, поэтому рН буферного раствора практически не изменяется. Кроме того, рКкислоты или рКоснования не зависит от разбавления. 2.Добавление кислот и оснований. При добавлении в ацетатный буфер небольшого количества сильной кислоты ионы Н+ (образующиеся при ее диссоциации) связываются с ацетат-ионами, содержащимися в избытке, с образованием слабодиссоциирующих молекул СН3СООН. Степень диссоциации СН3СООН мала и концентрация [Н+ ] практически не меняется, рН буферного раствора уменьшится, но незначительно.
20) Гидролиз солей. Типы гидролиза. Количественные характеристики гидролиза.
Гидролизом соли принято называть взаимодеи̌ствие ионов соли с ионами воды, ĸᴏᴛᴏᴩᴏᴇ приводит к образованию слабых электролитов.
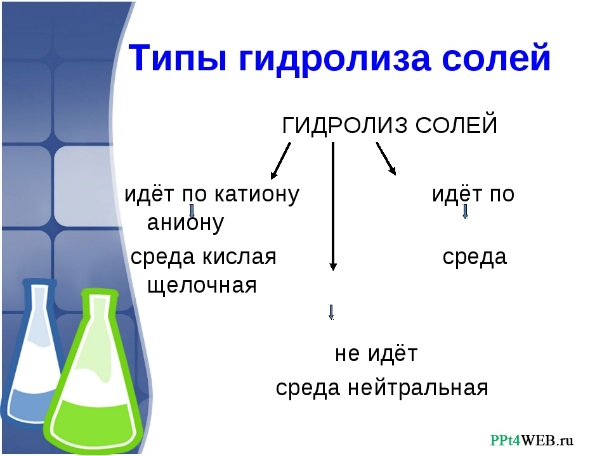
Количественно гидролиз соли характеризуется степенью гидролиза h и константой гидролиза К.
Степень гидролиза. Показателем глубины протекания гидролиза является степень гидролиза. Доля вещества, подвергшегося гидролизу, называется степенью гидролиза:
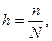 (5.13)
(5.13)
где h - степень гидролиза;
п - количество прогидролизованных частиц;
N - общее число молекул вещества.
Степень гидролиза зависит от температуры, концентрации соли, константы гидролиза.
Константа гидролиза. Если представить уравнение гидролиза в общем виде:
МА + Н2О «HА + МОН, где МА - соль;
НА - кислота;
МОН - основание,
то константа равновесия этой реакции будет следующая:
 .
.
21)Понятие об окислительно-восстановительных реакциях (ОВР)
Окислительно-восстановительные реакции – это реакции, сопровождающиеся переходом электронов от одних атомов или ионов к другим, другими словами – это реакции, в результате которых изменяются степени окисления элементов.
Степень окисления – это заряд атома элемента в соединении, вычисленный из условного предположения, что все связи в молекуле являются ионными.
Окисление и восстановление. Окислением называется отдача электронов, в результате чего степень окисления элемента повышается. Восстановлением называется присоединение электронов, в результате чего степень окисления элемента понижается.
Окислительные и восстановительные процессы тесно связаны между собой, так как химическая система только тогда может отдавать электроны, когда другая система их присоединяет (окислительно-восстановительная система). Присоединяющая электроны система (окислитель) сама восстанавливается (превращается в соответствующий восстановитель), а отдающая электроны система (восстановитель), сама окисляется (превращается в соответствующий окислитель).
ОВР делятся на три группы:
1) межмолекулярные;
2) внутримолекулярные;
3) реакции диспропорционирования.
|
|
|


