 |
II. Кривая титрования слабой кислоты сильным основанием.
|
|
|
|
II. Кривая титрования слабой кислоты сильным основанием.
При расчете кривой титрования слабой кислоты щелочью следует учитывать тот факт, что до точки эквивалентности в растворе присутствует буферная смесь, состоящая из неоттитрованной слабой кислоты и ее соли, образованной за счет взаимодействия слабой кислоты со щелочью. В точке эквивалентности в растворе присутствует соль, образованная слабой кислотой и сильным основанием, она подвергается гидролизу и среда становится щелочной, в отличие от точки эквивалентности в случае титрования сильной кислоты щелочью.
За точкой эквивалентности в растворе, как и в случае титрования сильной кислоты, будет находиться в избытке щелочь, и ее содержание в растворе будет определять рН.
Пример.
Построить кривую титрования 10, 0 мл 0, 1 М CH3COOH раствором 0, 1 М NaOH. Расчетные данные приведены в табл. 4.
Решение:
В первоначальный момент (без добавления NaOH) в растворе присутствует слабая кислота, расчет рН ведется по формуле
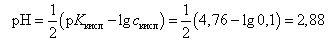 (13)
(13)
Во всех последующих точках на кривой титрования до точки эквивалентности (в том числе в начале скачка на кривой титрования) расчет рН ведут для буферной системы (смесь CH3COOH и ее соли CH3COONa) по формуле
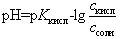 (14)
(14)
Концентрация оставшейся уксусной кислоты в растворе вычисляется по формуле
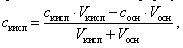 (15)
(15)
а концентрация ацетата натрия – по формуле
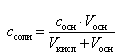 (16)
(16)
Например, при добавлении 9, 0 мл 0, 1 М NaOH
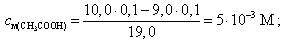
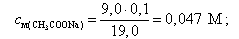
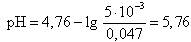
Значение рН в начале скачка на кривой титрования (добавлено 9, 99 мл 0, 1 М NaOH) рассчитывается по формуле
|
|
|

Таблица 4.
Расчет кривой титрования 10, 0 мл 0, 1 М СH3COOH раствором 0, 1 М NaOH
| № | V(NaOH), мл | 
| 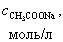
| 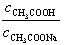
| [OH-], моль/л | pH |
| 1. | 0, 00 | 0, 10 | - | - | - | 2, 88 |
| 2. | 2, 50 | 0, 06 | 0, 020 | 3, 000 | - | 4, 28 |
| 3. | 5, 00 | 0, 03 | 0, 030 | 1, 000 | - | 4, 76 |
| 4. | 9, 00 | 5 · 10-3 | 0, 047 | 0, 100 | - | 5, 76 |
| 5. | 9, 90 | 5 · 10-4 | 0, 050 | 0, 010 | - | 6, 76 |
| 6. | 9, 99 | 5 · 10-5 | 0, 050 | 0, 001 | - | 7, 76 |
| 7. | 10, 00 | - | 0, 050 | - | - | 8, 76 |
| 8. | 10, 01 | - | 0, 050 | - | 5 ·10- 5 | 9, 7 |
| 9. | 10, 10 | - | 0, 050 | - | 5 ·10- 4 | 10, 7 |
| 10. | 11, 00 | - | 0, 047 | - | 5 ·10- 3 | 11, 7 |
| 11. | 15, 00 | - | 0, 040 | - | 0, 02 | 12, 3 |
В общем случае рН в начале скачка на кривой титрования слабой одноосновной кислоты можно вычислить по формуле
pH = pK + 3 (17)
Эта формула получается с учетом того факта, что логарифм отношения количества неоттитрованной кислоты (0, 1 %) к количеству полученной соли (99, 9 %) в данном случае
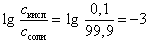
В точке эквивалентности (по закону эквивалентов должно быть добавлено 10, 0 мл 0, 1 М NaOH) рН рассчитывается для гидролизующейся соли CH3COONa по формуле
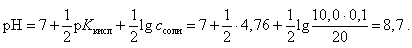 (18)
(18)
За точкой эквивалентности расчет рН ведется аналогичным образом, как и в случае титрования сильной кислоты щелочью. Внешний вид кривой титрования приведен на рис. 2.
Анализ кривой титрования
Характерной особенностью кривых титрования слабых одноосновных кислот является несовпадение точки эквивалентности с точкой нейтральности и расположение точки эквивалентности в щелочной области. Величина скачка на кривой титрования значительно меньше, чем в случае титрования сильной кислоты щелочью. Так, в данном случае рН = рН конца скачка - рН начала скачка = 9, 7 - 7, 76 = 1, 94 вместо 5, 4 единиц при титровании 0, 1 М HCl раствором 0, 1 М NaOH. В данном случае в качестве индикатора можно использовать только фенолфталеин, интервал перехода окраски которого лежит в щелочной среде и попадает в область скачка на кривой титрования. Метиловый оранжевый применять нельзя, так как он изменит свою окраску раньше достижения точки эквивалентности.
|
|
|
Величина скачка уменьшается с уменьшением концентрации кислоты, с возрастанием температуры, с уменьшением константы диссоциации слабой кислоты. При Kкисл < 10- 6 скачок исчезает вообще.
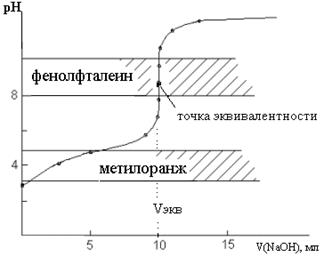
Рис. 2. Кривая титрования 10 мл 0, 1 М CH3COOH раствором 0, 1 М NaOH
|
|
|


