 |
III. Кривая титрования слабого основания сильной кислотой.
|
|
|
|
III. Кривая титрования слабого основания сильной кислотой.
При построении кривой титрования слабого основания сильной кислотой исходят из тех же соображений, что и в случае титрования слабой кислоты щелочью. В первоначальный момент рН раствора определяется диссоциацией слабого основания. До точки эквивалентности в растворе будет присутствовать буферная смесь, состоящая из неоттитрованного слабого основания и его соли. В точке эквивалентности находится только соль слабого основания и сильной кислоты, которая подвергается гидролизу и создает кислую среду. За точкой эквивалентности рН определяется избыточным содержанием в растворе сильной кислоты.
Пример.
Построить кривую титрования 10, 0 мл 0, 1 М NH4OH раствором 0, 1 М HCl.
Решение:
Расчетные данные приведены в табл. 5.
В первоначальный момент (кислота не добавлена) рН раствора определяется по формуле
 (19)
(19)
Таблица 5.
Расчет кривой титрования 10, 0 мл 0, 1 М NH4OH раствором 0, 1 М HCl
| № | V(HCl), мл | 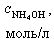
| 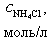
| 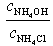
| [H+], моль/л | pH |
| 1. | 0, 00 | 0, 10 | - | - | - | 11, 12 |
| 2. | 2, 50 | 0, 06 | 0, 020 | 3, 000 | - | 9, 72 |
| 3. | 5, 00 | 0, 03 | 0, 030 | 1, 000 | - | 9, 24 |
| 4. | 9, 00 | 5 · 10 - 3 | 0, 047 | 0, 100 | - | 8, 24 |
| 5. | 9, 90 | 5 · 10 - 4 | 0, 050 | 0, 010 | - | 7, 24 |
| 6. | 9, 99 | 5 · 10 - 5 | 0, 050 | 0, 001 | - | 6, 24 |
| 7. | 10, 00 | - | 0, 050 | - | - | 5, 27 |
| 8. | 10, 01 | - | 0, 050 | - | 5 · 10- 5 | 4, 30 |
| 9. | 10, 10 | - | 0, 050 | - | 5 · 10- 4 | 3, 30 |
| 10. | 11, 00 | - | 0, 047 | - | 5 · 10- 3 | 2, 30 |
| 11. | 15, 00 | - | 0, 040 | - | 0, 02 | 1, 70 |
При добавлении 9, 0 мл 0, 1 М HCl концентрация неоттитрованного слабого основания и его соли рассчитывается следующим образом:
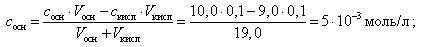 (20)
(20)
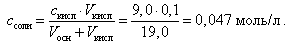 (21)
(21)
Расчет рН буферной смеси ведут по формуле
|
|
|
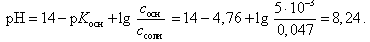 (22)
(22)
Аналогично рассчитывается рН в начале скачка на кривой титрования.
Значение рН в начале скачка на кривой титрования (добавлено 9, 99 мл 0, 1 М HCl) можно рассчитать с учетом следующих соображений: в растворе останется 0, 1 % неоттитрованного одноосновного слабого основания и образуется 99, 9 % соли:
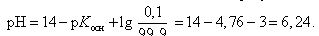
В точке эквивалентности (добавлено 10, 0 мл 0, 1 М HCl)
 (23)
(23)
За точкой эквивалентности в растворе находится избыток сильной кислоты, следовательно, концентрация [H+]-ионов определяется по формуле (9).
Например, в конце скачка титрования (V(HCl) = 10, 01 мл)
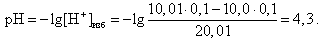
Внешний вид кривой титрования изображен на рис. 3.
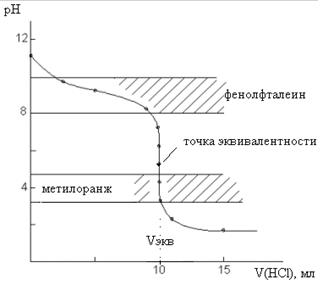
Рис. 3. Кривая титрования 10 мл 0, 1 М NH4OH раствором 0, 1 М HCl
Анализ кривой титрования
При титровании слабого основания сильной кислотой скачок на кривой титрования и точка эквивалентности лежат в кислой среде. В данном случае скачок лежит в интервале от 6, 24 до 4, 3. Δ рН составляет ~1, 9 единиц, т. е. значительно меньше скачка на кривой титрования сильного основания сильной кислотой. В качестве индикатора можно использовать метиловый оранжевый, изменяющий окраску в этой области. Применять фенолфталеин нельзя, так как его интервал перехода окраски не попадает в область скачка не кривой титрования.
IV. Кривая титрования слабого основания слабой кислотой.
В этом случае практически отсутствует скачок на кривой титрования (например, титрование CH3COOH раствором NH4OH), поэтому такой метод не применим на практике.
Примеры решения задач
Пример 1.
Вычислите рН, рОН, [ОН-] спинномозговой жидкости, если [H+]=3. 9·10-8моль/л.
Решение:
Согласно определению pH = -lg[H+] = -lg(3. 9·10-8)= -lg3. 9 -lg10-8=8-lg3. 9=7. 4
Показатель рОН легко найти, пользуясь соотношением рН+рОН=14.
Тогда получаем рОН=14-рН=14-7. 4=6. 6
Концентрацию гидроксильных ионов найдем, пользуясь определением рОН:
|
|
|
рОН=-lg[ОН-]=6. 6; lg[ОН-]=-6. 6; [ОН-] =10-6. 6 = 2. 5·10-7
или вспомним, что ионное произведение воды Кw=[H+]·[ОН-]=1·10-14, тогда
[ОН-]=1·10-14/[H+]= 1·10-14/3. 9·10-8=0. 25·10-6= 2. 5·10-7
Ответ: 7. 4; 6. 6; 2. 5·10-7
Пример 2.
Предскажите значение pH (больше 7, меньше 7, равно 7) в водных растворах следующих солей: KCl, Na2S, Fe(NO3)2, СН3СООNH4.
Решение:
Различные соли создают кислую либо щелочную среду в водных растворах благодаря гидролизу. Не рассматривая механизм этого процесса, можно примерно предсказать результат, зная относительную силу кислот и оснований (аниона и катиона), которые образуют данную соль.
Вспомним основные сильные и слабые кислоты и основания.
Сильные кислоты (диссоциируют полностью): HClO4, HClO3, HNO3, H2SO4, HMnO4, HCl, HBr, HI. ( Большинство оксикислот, содержащих центральный атом в высшей степени окисления, а также все бескислородные кислоты, образованные элементами VIIA группы, за исключениемHF. )
Сильные основания (диссоциируют полностью): LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2.
Слабые кислоты (не подвергаются полной диссоциации): большинство органических кислот(CH3COOH, C6H5OH, …), некоторые минеральные кислоты (HClO2, HClO, HNO2, H2SO3, H2CO3, H2SiO3, H3PO3, H3BO3, H2S, HCN, HF,... )
Слабые основания (не подвергаются полной диссоциации): большинство органических оснований (C6H5NH2, (CH3)2NH, …), нерастворимые минеральные основания (Fe(OH)2, Pb(OH)2, Cu(OH)2, …), гидроксид аммония (NH4OH).
Так как KCl содержит остаток сильного основания КOH и сильной кислоты HCl, такая соль не подвергается гидролизу, среда остается нейтральной, pH = 7.
Na2S содержит катион сильного основания NaOH и анион слабой кислоты H2S, поэтому протекает гидролиз по аниону, pH> 7, щелочная среда.
Fe(NO3)2 содержит остаток сильной кислоты HNO3 и слабого основания Fe(OH)2, подвергается гидролизу по катиону, pH< 7, кислая среда. Для СН3СООNH4 гидролиз протекает и по аниону, и по катиону, образуется нейтральная среда, так как в составе соли остатки двух слабых электролитов с равными значениями констант диссоциации.
Ответ: pH=7; pH> 7; pH< 7; pH=7.
Пример 3.
Раствор амидопирина оттитровали 0. 1N раствором HCl. На титрование 1. 0 мл лекарственного препарата было затрачено 2. 16 мл кислоты. Найдите процентную концентрацию амидопирина, если его эквивалент равен 231. 3 г/моль, плотность раствора принять равной 1 г/мл. Что можно сказать о значении pH в точке эквивалентности? Без построения кривой титрования, предположите, какой можно было бы использовать индикатор.
|
|
|
Решение:
По закону эквивалентов
CN(основания)·V(основания)=CN(кислоты)·V(кислоты),
поэтому в нашем случае С(ам. )·V(ам. )=C(HCl)·V(HCl), и получаем С(ам. )=2. 16·0. 1/1. 0=0. 216N
Для нахождения процентной концентрации найдем массу амидопирина в 100г (без учета плотности 100г=100мл=0. 1л) раствора:
m= CN ·Э ·V= 0. 216 ·231. 3 ·0. 1=4. 996г
Таким образом, процентная концентрация амидопирина составляет 4. 996 ≈ 5%
При титровании слабого органического основания сильной кислотой точка эквивалентности смещается в кислую область (pHт. экв. < 7), поэтому рН перехода окраски индикатора (или его показатель титрования рТ) тоже должен находиться в этой области. В данном анализе применяется метиловый оранжевый (переход окраски желтый/красный в области рН=3. 1-4. 4). Для точного выбора индикатора обязательным условием является построение кривой титрования.
Ответ: 5%; pHт. экв. < 7.
|
|
|


