 |
3.1.4 Многовариантное задание №8 «Гальванические элементы»
|
|
|
|
1. Какого рода левый электрод гальванического элемента А (таблица 3. 1)? Напишите уравнение реакции, протекающей на этом электроде в равновесных условиях, и уравнение для расчета потенциала этого электрода.
2. Определите среднюю ионную активность электролита a± в левом электроде гальванического элемента А на основании справочных значений среднего ионного коэффициента активности электролита [2] при моляльной концентрации m1 (таблица 3. 2) и температуре 298 К.
3. Определите электродный потенциал левого электрода при 298 К. Стандартный электродный потенциал возьмите из справочника [2]. Давление в газовых электродах примите равным стандартному атмосферному давлению.
4. Какого рода правый электрод гальванического элемента А (таблица 3. 1)? Напишите уравнение реакции, протекающей на этом электроде в равновесных условиях, и уравнение для расчета потенциала этого электрода
5. Определите среднюю ионную активность электролита a± в правом электроде гальванического элемента А на основании справочных значений среднего ионного коэффициента активности электролита [2] при моляльной концентрации m2 (таблица 3. 2) и температуре 298 К.
6. Определите электродный потенциал правого электрода при 298 К. Стандартный электродный потенциал возьмите из справочника [2]. Давление в газовых электродах примите равным стандартному атмосферному давлению.
7. Напишите электродные реакции, протекающие на отрицательном и положительном электродах и суммарную химическую реакцию, протекающую самопроизвольно при работе гальванического элемента А.
8. Определите электродвижущую силу (ЭДС) гальванического элемента А и максимальную полезную электрическую работу, которую можно получить при работе данного элемента при температуре 298 К.
|
|
|
9. Вычислите термодинамическую константу равновесия реакции, протекающей самопроизвольно в гальваническом элементе А при температуре 298 К.
10. Составьте гальванический элемент, в котором протекает самопроизвольно химическая реакция В (таблица 3. 3).
11. Определите стандартное значение ЭДС гальванического элемента, в котором протекает химическая реакция В, при температуре 298 К на основании стандартных электродных потенциалов из справочника [2].
12. Определите Е0при температуре T на основании значения Е0 при 298 К и величины  (таблица 3. 3), приняв что в указанном интервале температур зависимость Е0 = f(T) линейна.
(таблица 3. 3), приняв что в указанном интервале температур зависимость Е0 = f(T) линейна.
13. Определите  (кДж/моль) реакции В, протекающей в гальваническом элементе при температуре T (таблица 3. 4).
(кДж/моль) реакции В, протекающей в гальваническом элементе при температуре T (таблица 3. 4).
14. Определите  (Дж/(моль∙ К)) для реакции В, протекающей в гальваническом элементе при температуре T.
(Дж/(моль∙ К)) для реакции В, протекающей в гальваническом элементе при температуре T.
15. Определите тепловой эффект 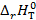 (кДж/моль) реакции В, протекающей в гальваническом элементе при температуре T.
(кДж/моль) реакции В, протекающей в гальваническом элементе при температуре T.
16. Определите термодинамическую константу равновесия химической реакции В при температуре T.
Таблица 3. 1 – Варианты заданий
| Вар. | Гальванический элемент А |
| Zn|ZnSO4||KCl|AgCl(s)|Ag | |
| (Pt)H2|H2SO4||KCl|Hg2Cl2(s)|Hg | |
| Cu|CuCl2||CdSO4|Hg2SO4(s)|Hg | |
| Pb|PbSO4|Na2SO4||HCl|H2(Pt) | |
| Fe|FeCl2||H2SO4|Ag2SO4(s)|Ag | |
| Pb|PbI2(s)|KI||SnCl2|Sn | |
| Cd|CdSO4||HCl|Cl2(Pt) | |
| Hg|Hg2SO4|CdSO4||AgNO3|Ag | |
| (Pt)H2|H2SO4||NaBr|AgBr(s)|Ag | |
| Cd|CdSO4||HCl|CuCl(s)|Cu | |
| Pb|Pb(NO3)2||KI|I2(Pt) | |
| Ni|NiSO4||KBr|Hg2Br2(s)|Hg | |
| Ca|Ca(OH)2(s)|NaOH||SnCl2|Sn | |
| Tl|TlCl||CdCl2|Cl2(Pt) | |
| Tl|TlI(s)|KI||CuSO4|Cu | |
| Tl|TlCl(s)|NaCl||BaCl2|Cl2(Pt) | |
| Cu|Cu2O(s)|KOH||KOH|O2(Pt) |
Продолжение таблицы 3. 1
| Вар. | Гальванический элемент А |
| Pb|PbBr2(s)|NaBr||KBr|Br2(Pt) | |
| (Pt)H2|NaOH||NaCl|PbCl2(s)|Pb | |
| Cu|CuI(s)|NaI||CdCl2|Cl2(Pt) | |
| Li|LiCl||KI|AgI(s)|Ag | |
| Zn|ZnCl2||NaI|Hg2I2(s)|Hg | |
| Cd|CdI2||NaOH|HgO(s) |Hg | |
| Cs|CsCl||KOH|Ag2O(s)|Ag | |
| Cd|CdCl2||HCl|Sb2O3(s)|Sb | |
| Cd|CdSO4||KI|I2(Pt) |
Таблица 3. 2 – Варианты заданий
| Вариант
| Моляльная концнентрация растворов, m, моль/кг H2O | Подвариант | |||||||
| 1, 2, 3, 4, 7, 9, 15, 18, 26 | m1 m2 | 0, 005 0, 2 | 0, 01 0, 1 | 0, 02 0, 05 | 0, 05 0, 02 | 0, 1 0, 01 | 0, 2 0, 005 | ||
| 12, 17, 19, 20, 22, 23, 24 | m1 m2 | 0, 1 0, 5 | 0, 2 2, 0 | 0, 5 1, 0 | 1, 0 0, 5 | 2, 0 0, 2 | 0, 5 0, 1 | ||
| 5, 6, 10, 13, 16, 21 | m1 m2 | 0, 01 0, 1 | 0, 02 0, 05 | 0, 05 0, 02 | 0, 1 0, 01 | 0, 2 0, 005 | 0, 5 0, 001 | ||
| 8, 11, 14, 25 | m1 m2 | 0, 001 0, 05 | 0, 002 0, 1 | 0, 01 0, 02 | 0, 001 0, 2 | 0, 002 0, 5 | 0, 01 1, 0 | ||
Таблица 3. 3 – Варианты заданий
| Вариант | Химическая реакция В |  В/К В/К
|
| Pb + 2AgI = PbI2 + 2Ag | 
| |
| Cd + 2AgCl = CdCl2 + 2Ag | 
| |
| Cd + PbCl2 = CdCl2 + Pb | 
| |
| Cd + Hg2SO4 = CdSO4 + 2Hg | 
| |
| H2 + Hg2SO4 = H2SO4 +2Hg | 
| |
| Zn + Hg2SO4 = ZnSO4 +2Hg | 
| |
| Pb + 2AgI = PbI2 + 2Ag | 
| |
| Cd + 2AgCl = CdCl2 + 2Ag | 
| |
| Cd + PbCl2 = CdCl2 + Pb | 
| |
| Cd + Hg2SO4 = CdSO4 + 2Hg | 
| |
| H2 + Hg2SO4 = H2SO4 +2Hg | 
| |
| Zn + Hg2SO4 = ZnSO4 +2Hg | 
| |
| Ni + 2CoCl3 = NiCl2 + 2CoCl2 | 
| |
| FeCl3 + 3CrCl2 = Fe + 3CrCl3 | 
| |
| Zn + 2TlOH = Zn(OH)2 + 2Tl | 
| |
| Tl + Cu(NO3)2 = TlNO3 + CuNO3 | 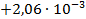
| |
| Zn + 2FeCl3 = ZnCl2 + 2FeCl2 | 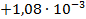
| |
| NaI3 +Na2S = 3NaI +S | 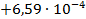
| |
| Fe + Tl(NO3)3 = Fe(NO3)2 + TlNO3 | 
| |
| Ni + 2CoCl3 = NiCl2 + 2CoCl2 | 
| |
| FeCl3 + 3CrCl2 = Fe + 3CrCl3 | 
| |
| Zn + 2TlOH = Zn(OH)2 + 2Tl | 
| |
| Tl + Cu(NO3)2 = TlNO3 + CuNO3 | 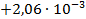
| |
| Zn + 2FeCl3 = ZnCl2 + 2FeCl2 | 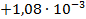
| |
| Fe + Tl(NO3)3 = Fe(NO3)2 + TlNO3 | 
| |
| Hg2Cl2 +2Ag = 2AgCl + 2Hg | 
|
Таблица 3. 4 – Варианты заданий
| Вариант | Температура T, К | |||||
| Подвариант | ||||||
| 1, 2, 3, 4, 5, 6, 13, 14, 15, 16, 17, 18, 19, 26 | ||||||
| 7, 8, 9, 10, 11, 12, 20, 21, 22, 23, 24, 25 | ||||||
|
|
|


