 |
2. 3 контрольные вопросы. 2. 4 вопросы к теоретическому коллоквиуму по теме «фазовые равновесия». 3 электрохимические системы
|
|
|
|
2. 3 Контрольные вопросы
1. Чем отличаются понятия фаза и агрегатное состояние вещества?
2. Что является условием фазового равновесия в системе?
3. Чем отличается число компонентов от числа составляющих веществ системы?
4. Что показывает число степеней свободы системы?
5. Что такое насыщенный пар вещества?
6. Что такое теплота испарения вещества?
7. Какие равновесия описывает уравнение Клапейрона-Клаузиуса?
8. Что называется раствором?
9. Какие растворы называются идеальными, а какие неидеальными?
10. Для каких растворов выполняется закон Рауля?
11. В чем причина положительных и отрицательных отклонений от закона Рауля?
12. Что такое активность компонента в растворе?
13. Какие свойства растворов называют коллигативными?
14. Что показывает изотонический коэффициент?
15. Какую информацию несут диаграммы состояния двухкомпонентных систем?
16. Что такое нода или коннода? Как определить составы равновесных фаз?
17. Что такое эвтектическая смесь?
18. Что показывают линии ликвидуса и солидуса?
19. Что называется кривыми охлаждения?
20. Как по кривой охлаждения определить температуры фазовых превращений?
21. Как определить устойчивость химического соединения, образующегося между компонентами в твердом агрегатном состоянии?
22. В чем различие между точками перитектики и дистектики?
23. В чем заключаются основные различия между типами твердых растворов?
24. В чем заключаются правила Розебома?
25. Что такое разрыв сплошности твердого раствора?
2. 4 Вопросы к теоретическому коллоквиуму по теме «Фазовые равновесия»
1. Растворимость газов в жидкостях. Закон Генри.
2. Влияние давления и температуры на растворимость газов в жидкостях.
|
|
|
3. Идеальные и неидеальные растворы. Причины отклонения от закона Рауля.
4. Выражение для химического потенциала идеального и реального растворов.
5. Метод физико-химического анализа. Диаграммы состав-свойство. Принципы непрерывности и соответствия Н. С. Курнакова.
6. Неограниченно растворимые друг в друге жидкости. Вычисление давления и состава пара над идеальными растворами.
7. Диаграммы общее давление – состав, температура кипения – состав, состав раствора – состав пара для двухкомпонентных идеальных растворов. Первый закон Гиббса-Коновалова.
8. Диаграммы температура кипения – состав, состав раствора – состав пара для неидеальных растворов с положительными отклонениями от закона Рауля.
9. Диаграммы температура кипения – состав, состав раствора – состав пара для неидеальных растворов с отрицательными отклонениями от закона Рауля.
10. Азеотропные растворы. Второй закон Коновалова-Гиббса.
11. Методы разделения жидкостей. Виды перегонки.
12. Правило рычага и его применение.
13. Ограниченная взаимная растворимость жидкостей. Влияние температуры на растворимость.
14. Диаграммы общее давление – состав, температура кипения – состав, состав раствора – состав пара для систем с ограниченной взаимной растворимостью жидкости.
15. Давление и состав пара над смесью взаимно нерастворимых жидкостей. Перегонка с водяным паром
16. Идеальная растворимость твердых веществ в жидкости (уравнение Шредера).
17. Термический анализ, кривые охлаждения.
18. Системы с полной взаимной нерастворимостью веществ в твердом и жидком состояниях.
19. Диаграммы плавкости систем с полной растворимостью компонентов в жидком и полной нерастворимостью в твердом состояниях (системы с простой эвтектикой).
20. Диаграммы плавкости систем с ограниченной растворимостью компонентов в твердом состоянии.
|
|
|
21. Диаграммы плавкости систем с неограниченной растворимостью веществ в твердом состоянии. Типы твердых растворов.
22. Диаграммы плавкости систем с устойчивыми химическими соединениями.
23. Диаграммы плавкости систем с неустойчивыми химическими соединениями.
24. Коллигативные свойства разбавленных растворов. Использование их для определения молекулярного состава и молярной массы вещества.
25. Разбор диаграммы состояния.
3 ЭЛЕКТРОХИМИЧЕСКИЕ СИСТЕМЫ
3. 1 Гальванические элементы
Электрохимической системой называется часть пространства, в которой может протекать, по меньшей мере, одна электрохимическая окислительная и одна электрохимическая восстановительная реакции. Примерами электрохимических систем являются гальванические элементы, электролизеры, металлы в растворах электролитов, в том числе в морской и речной воде и во влажной атмосфере воздуха.
Гальванические элементы представляют собой электрохимическую систему, состоящую из двух электродов. В электрохимических системах окислительно-восстановительные реакции протекают на поверхности электродов.
Электрод – это система, состоящая из проводника первого рода (с электронной проводимостью) и проводника второго рода (с ионной проводимостью). Проводники первого рода: металлы, некоторые оксиды металлов, графит, пирографит. Проводники второго рода: растворы и расплавы электролитов, твердые электролиты.
Электродный процесс можно представить следующей схемой:
восстановление
Окисленная форма + 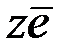 Восстановленная форма
Восстановленная форма
окисление
Совокупность двух указанных процессов приводит к установлению в системе термодинамического равновесия, при котором восстановительный и окислительный процессы протекают с одинаковыми скоростями.
Уравнение равновесной электродной реакции:
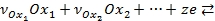
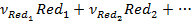 , (3. 1)
, (3. 1)
где  - окисленная форма вещества;
- окисленная форма вещества;
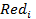 – восстановленная форма вещества.
– восстановленная форма вещества.
В результате протекания этой равновесной реакции на границе металл | раствор возникает двойной электрический слой и устанавливается скачок потенциала, зависящий как от природы металла, так и от концентрации (активности) потенциал-определяющих ионов в растворе.
|
|
|
Истинные (абсолютные) значения электродных потенциалов невозможно ни измерить, ни рассчитать, поэтому эти величины определяют по отношению к выбранному стандарту. За стандарт принят стандартный водородный электрод, потенциал которого принят за ноль. В такой условной водородной шкале потенциалы могут быть измерены экспериментально, а также рассчитаны по уравнению Нернста :
 (3. 2)
(3. 2)
где E0 – стандартный потенциал электрода, В;
R – универсальная газовая постоянная, 8, 314 Дж/моль∙ К;
T – температура, К;
z – число электронов, участвующих в электродной реакции;
F – число Фарадея, 96485 Кл/моль;
 - активность окисленной формы вещества;
- активность окисленной формы вещества;
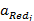 - активность восстановленной формы вещества;
- активность восстановленной формы вещества;
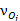 ,
,  – стехиометрические коэффициенты при окисленной и восстановленной формах вещества в уравнении равновесной электродной реакции.
– стехиометрические коэффициенты при окисленной и восстановленной формах вещества в уравнении равновесной электродной реакции.
Активности индивидуальных простых и сложных веществ принимаются равными единице. Стандартным электродным потенциалом (E0) называется потенциал электрода при активностях окисленной и восстановленной форм вещества, равных единице. Стандартный потенциал дает, как правило, основной вклад в величину электродного потенциала.
Уравнение (3. 2) для расчета равновесного потенциала электрода в водородной шкале при 25 °С (298 К) может быть преобразовано:
 (3. 3)
(3. 3)
где 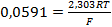 .
.
Электрод принято изображать следующим образом:
Окисленная форма вещества (Ox) | Восстановленная форма вещества (  )
)
Например,  |
| 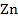 или
или  |
| 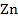 . Граница раздела фаз обозначается вертикальной чертой « | ».
. Граница раздела фаз обозначается вертикальной чертой « | ».
При схематическом изображении гальванического элемента слева записывается электрод, потенциал которого более отрицателен, справа записывается электрод, потенциал которого более положителен. Схема гальванического элемента должна начинаться и заканчиваться изображением проводника первого рода (металла, графита и др. ). Проводники второго рода (растворы или расплавы электролитов, твердые электролиты) разделяются или пористой мембраной или электролитическим мостиком. Мембрана изображается вертикальным пунктиром, а электролитический мостик двумя вертикальными чертами «||». Например, условное изображение медно-цинкового элемента:
|
|
|
(–) Zn | ZnSO4 || CuSO4 | Cu (+),
m1(a±, 1) m2(a±, 2)
где m1 и m2 – моляльные концентрации растворов электролитов,
a±, 1 и a±, 2 – средние ионные активности растворов электролитов.
При замыкании электродов гальванического элемента во внешней цепи возникает электрический ток за счет переноса электронов от отрицательного электрода к положительному. Электродвижущей силой (ЭДС), вызывающей появление электрического тока при замыкании внешней цепи, является разность электродных равновесных потенциалов. ЭДС (Е) гальванического элемента может быть рассчитана как:
Е = Е (+) – Е(–) (3. 4)
Таким образом, замкнутый гальванический элемент – это электрохимическая система, совершающая полезную электрическую работу Wэл. (Wэл. > 0). Максимальная полезная электрическая работа системы при изотермическом и обратимом проведении процесса определяется величиной ЭДС гальванического элемента:
Wэл., max = zFE (3. 5)
Так как Wэл., max > 0, то и ЭДС гальванического элемента Е > 0.
При замыкании электродов гальванического элемента и протекании электрического тока во внешней цепи химическое равновесие на электродах нарушается: на отрицательном электроде в сторону реакции окисления, генерирующей электроны, а на положительном в сторону реакции восстановления, поглощающей электроны. Таким образом, в замкнутом гальваническом элементе происходит направленное самопроизвольное протекание реакций. За счет суммарной самопроизвольной реакции, протекающей в гальваническом элементе и совершается электрическая работа.
Пример: Написать электродные реакции и суммарную реакцию, протекающую в замкнутом медно-цинковом гальваническом элементе:
(–) Zn | ZnSO4 || CuSO4 | Cu (+)
Решение:
На отрицательном цинковом электроде замкнутого медно-цинкового гальванического элемента протекает реакция:
(–): Zn – 2  → Zn2+.
→ Zn2+.
На положительном медном электроде замкнутого медно-цинкового гальванического элемента протекает реакция:
|
|
|
(+): Cu2+ + 2  → Cu.
→ Cu.
Уравнение суммарной реакции:
Zn + Cu2+ → Zn2+ + Cu.
Гальванические элементы широко используются как автономные химические источники тока (ХИТ). Однако для практического применения в качестве ХИТ целесообразно использовать только те гальванические элементы, ЭДС которых не менее 1 В.
На использовании гальванических элементов основаны методы потенциометрического исследования растворов электролитов и методы электрохимического анализа.
|
|
|


