 |
Изменение микробиоценоза желудочно-кишечного тракта уцыплят-бройлеров при колибактериозе под влиянием ветома 1.1
|
|
|
|
Многие авторы отмечают, что при замедленном формировании микробиоценозов пищеварительного тракта выживаемость цыплят зависит от санитарного состояния кормов, воды, окружающей среды. Микроэкологические изменения приводят к возникновению желудочно-кишечных болезней: диспепсии, гастроэнтерита, энтероколита, клоацита и токсико-септических инфекций.
Наиболее распространенной причиной желудочно-кишечных расстройств считают эшерихиозы (Урбан и соавт. 1984, Карпуть и соавт., 1989), которые из-за существенного влияния предрасполагающих условий на возникновение заболевания многие относят к факторным инфекциям (Грязнева, 1991; Подкопаев и соавт., 1967).
При диареях вообще, в том числе при энтеритной форме эшерихиоза, констатируют дисбактериоз. Он проявляется изменением количественного и качественного состава микрофлоры, нарушением соотношения между ее представителями и распределения в толстом и тонком кишечнике. Сами же изменения количественного и качественного состава нормальной, условно-патогенной кишечной микрофлоры приводят к нарушению процессов пищеварения и развитию диарей. Поэтому их профилактика должна быть неразрывно связана с таковой дисбактериозов (Антипов и соавт., 1985; Воробьев и соавт., 1997; Овод, 2003). Поэтому в систему профилактических мероприятий необходимо включать применение средств для формирования нормобиоза и колонизационной резистентности, среди которых ведущее место занимают пробиотики.
В нашей стране зарегистрировано более 30 наименований пробиотиков, которые применяют при диареях животных и птицы (Шевелева, 1999; Малик и соавт., 2001).
Антибактериальная активность симбионтов обусловлена способностью продуцировать спирты, перекись водорода, молочную, уксусную и другие органические кислоты, синтезировать лизоцим и антибиотики широкого спектра действия (лактолин, низин, ацидофилин, лактоцид и др.). Они могут угнетать рост других видов микроорганизмов также за счет более высокого биологического потенциала, быстрого размножения и достижения М-концентрации, более короткой lag-фазы, изменения рН или окислительно-восстановительного потенциала среды (Freter et al., 1974; Воробьев и соавт., 1999).
|
|
|
Благодаря тому, что симбионтные серотипы кишечной палочки обладают перекрестными антигенными свойствами с патогенными серотипами Е. cоli, макроорганизм, вырабатывая иммуноглобулины по отношению к первым, приобретает механизм защиты и к патогенным серотипам, хотя и никогда не имел с ними контакта (Feske, 1974).
И.Б. Куваева (1991) полагает, что антагонизм кишечной палочки обеспечивается также продукцией бактериоцинов (колицинов). Губительное действие на патогенных микроорганизмов симбионты могут оказывать за счет активации ферментов слюны и поджелудочной железы, а также секреции желез желудка и кишечника, деконьюгации солей желчных кислот. Симбионтная микрофлора способствует повышению общей неспецифической резистентности организма хозяина, активно участвуя в обменных процессах и поставляя ему жизненно важные пластические вещества.
В наибольшей степени антагонистическая активность выражена у ацидофильных бактерий, бифидобактерий, молочно-кислого стрептококка и др. (Антипов и соавт., 1989; Антипов, 1981,1991; Мурашова и соавт., 1999).
Анализ имеющихся литературных данных свидетельствует о многогранном воздействии пробиотиков на микроэкологию пищеварительного тракта.
Наиболее важными аспектами взаимодействия пробиотических штаммов с микрофлорой кишечника и организмом животного являются образование антибактериальных веществ, конкуренция за питательные вещества и места адгезии, изменение микробного метаболизма (увеличение или уменьшение ферментативной активности), стимуляция иммунной системы, противораковое и антихолестеринемическое действие (Лянная и соавт.,1986; Мирошник, 1999; Мурашова и соавт., 1999; Ильина и соавт., 1999, 2000; Тараканов, 2000).
|
|
|
В пищеварительном тракте человека, свиней, птицы обитает Lactobacillus reuteri. Установлено, что покоящиеся клетки этой гетероферментативной бактерии превращают глицерин в сильную антимикробную субстанцию, названную рейтерином. Рейтерин – низкомолекулярное, нейтральное, небелковое водорастворимое соединение, подавляет рост бактерий родов Escheriehia, Salmonella, Shigella, Proteus, Pseudomonas, Clostridium, Staphylococcus и в меньшей степени ингибирует представителей родов Streptococcus, Pediococcus, Leuconostos и Lactobacillus. Рейтерин является антимикробным, антидрожжевым, антигрибным, антипротозойным и антивирусным агентом (Axelsson, 1989).
Другой класс антагонистических соединений, продуцируемых лактобацилами, – бактериоцины. Это белковые комплексы с бактерицидной активностью, обычно проявляющиейся в пределах семейства Lactobacillaceae против видов, близкородственных бактерий – продуценту. Их продукция обнаружена у различных видов лактобацилл (De Klerk et al., 1967).
Несколько бактериоцинов обнаружили у L. Acidophilus. Barefoot et al., 1983 описали два бактериоцина: лактацин В и лактацин F.
По сообщениям Н.С. De Klerk et al. (1967), лактацин В ингибировал бактерии видов L. leuchmanii, L. bulgaricus, L. helveticus b L. lactis, а лактацин F, в дополнение к указанным, подавлял L. fermentum и Streptococcus faecalis.
Бактерицидное действие лактацина В возрастало пропорционально его концентрации. Лактацин В, очищенный препарат – белок с молекулярной массой 6000-6500 Да, имел такой же спектр антагонистической активности, что и «сырой» препарат. Лактацин F представляет собой пептид, состоящий примерно из 56 аминокислот (Muriana et al., 1991).
M.A. Daeshel et al. (1986) у L. plantarum выявили бактериоцин плантарицин А – бактерицидный против грамположительных бактерий (L. plantarum, L. pentosaceus и L. paramesenteroides), устойчивый к нагреванию (100 0С – 30 мин) и активный в интервале рН от 4 до 6,5.
Из штамма L. plantarum L 441 выделили плантарицин С с широким спектром антагонистического действия, представляющий собой пептид с молекулярной массой около 3500 Да (Conzales et al., 1994).
|
|
|
Продукция бактерицинов характерна также для L. helveticus. Они названы лактоцин 27 и гельветицин J. (Upreti et al., 1975).
Бактериоцины, продуцируемые L. brevis В 37 и L. casеi В 80, получили названия соответственно бревицин 37 и казеицин 80. Первый проявлял антагонистическую активность в отношении многих молочно-кислых бактерий и Nocardia corallina, тогда как второй ингибировал лишь один штамм L. casei В 109 (Rammelsberg et al.,1990).
Необходимо отметить, что кроме лактобацилл бактериоцины образуют грамотрицательные кишечные бактерии, энтерококки, стрептококки и многие другие систематические группы микроорганизмов. Среди бактерий рубца бактериоциногению обнаружили у Streptococcus bovis (Iverson et al., 1976) и анаэробов рода Butyrivibrio (Kalmohoff et al.,1997).
Бактериоциногения в экосистеме пищеварительного тракта птицы и животных является важной проблемой, требующей пристального внимания исследователей.
При изучении литературы мы обратили внимание на тот факт, что применение пробиотиков не всегда сопровождается положительным эффектом. В ряде исследований получены противоречивые результаты, что обусловлено, по-видимому, недостаточной изученностью этих препаратов, неудачным подбором входящих в их состав штаммов бактерий, технологическими проблемами при их производстве и другими причинами.
Исходя из изложенного, можно отметить, что изучение фармакологических свойств пробиотиков и влияния их на микрофлору пищеварительного тракта является актуальным и представляет большой интерес как в научном, так и в практическом отношениях.
Для изучения влияния ветома 1.1 на микробиоценоз желудочно-кишечного тракта цыплят-бройлеров, больных колибактериозом, исследовали содержимое зоба и химуса слепых отростков. Определяли количественное содержание бифидобактерий, количественный и качественный состав энтеробактерий, патогенную кишечную микрофлору по общепринятым методикам В.А. Знаменского, утвержденным МЗ УССР 10 октября 1986 г.
Микробиологические исследования содержимого зоба и химуса слепых отростков выявили высокую индивидуальную вариабельность в численности бактерий различных групп у подопытных цыплят-бройлеров разного возраста.
|
|
|
До применения пробиотика в содержимом зоба 30-суточных бройлеров опытных и контрольной групп количество бифидо-, лактобактерий, эшерихий, гемолитических бактерий, сальмонелл и энтерококков было на одном уровне (табл. 27, рис.1).
Таблица 27. Микрофлора содержимого зоба у цыплят-бройлеров, больных колибактериозом, до лечения, lg, КОЕ/г
| Микроорганизмы | Группа | ||
| контрольная | 1-я опытная | 2-я опытная | |
| Бифидобактерии | 7,71±0,13 | 7,70±0,13 | 7,70±0,07 |
| Лактобактерии | 7,46±0,18 | 7,47±0,09 | 7,48±0,11 |
| Эшерихии | 7,38±0,14 | 7,36±0,13 | 7,35±0,14 |
| Гемолитические | 4,41±0,13 | 4,41±0,21 | 4,35±0,19 |
| Сальмонеллы | 1,70±0,99 | 1,0±0,76 | 1,16±0,82 |
| Энтерококки | 3,78±0,37 | 3,71±0,31 | 4,02±0,24 |
Через 5 суток после выздоровления в содержимом зоба 40-суточных цыплят 1-й и 2-й опытных групп численность бифидо-, лактобактерий по сравнению с исходными данными увеличивалась соответственно на 21,6 и 21,3; 1,1 и 2 %, а эшерихий, гемолитических бактерий, энтерококков уменьшалась соответственно на 1 и 0,5; 18,5 и 21,2; 7,2 и 12,3 %.
Сальмонелл в содержимом зоба у цыплят-бройлеров 1-й опытной группы не обнаружено, а у подопытных цыплят 2-й группы их количество уменьшилось относительно исходных данных на 5,5 %. В контрольной группе относительно исходных данных уменьшилось содержание бифидо- и лактобактерий соответственно на 0,5 и 1,4 %, а эшерихий, гемолитических бактерий, сальмонелл и энтерококков увеличилось на 2,3; 1,6; 23,5 и 2,9 %. По сравнению с аналогами из контроля у птицы 1-й и 2-й опытных групп возросла численность бифидобактерий соответственно на 22,5 и 22,3 % (P<0,001), лактобактерий - на 2,6 и 3,7 (табл. 28, рис.2).
Таблица 28. Микрофлора содержимого зоба у цыплят-бройлеров, больных колибактериозом, через 5 суток после выздоровления, lg, КОЕ/г
| Микроорганизмы | Группа | ||
| контрольная | 1-я опытная | 2-я опытная | |
| Бифидобактерии | 7,64±0,12 | 9,36±0,05*** | 9,34±0,05*** |
| Лактобактерии | 7,36±0,18 | 7,55±0,09 | 7,63±0,10 |
| Эшерихии | 7,57±0,06 | 7,29±0,09# | 7,31±0,10# |
| Гемолитические | 4,34±0,10 | 3,72±0,20# | 3,59±0,19* |
| Сальмонеллы | 2,10±0,78 | 0,0±0,00 | 1,10±0,80 |
| Энтерококки | 3,89±0,25 | 3,46±0,23* | 3,58±0,34# |

 Рис. 1. Процентное соотношение микрофлоры в содержимом зоба до лечения.
Рис. 1. Процентное соотношение микрофлоры в содержимом зоба до лечения. 


Рис. 2. Процентное соотношение микрофлоры в содержимом зоба через 5 суток после выздоровления
У цыплят 1-й и 2-й опытных групп по сравнению с аналогами из контроля количество эшерихий было меньше соответственно на 3,8 и 3,6 % (P<0,1), гемолитических - на 16,7 (P<0,1) и 20,9 (P<0,05), энтерококков – на 12,4 (P<0,05) и 8,7 (P>0,1), сальмонелл в содержимом зоба у цыплят 1-й опытной группы не обнаружено, а у 2-й группы их количество уменьшилось по сравнению с аналогами из контроля на 90,9 %.
|
|
|
Через 15 суток после выздоровления в содержимом зоба бройлеров опытных групп численность бифидобактерий снизилась, а лактобактерий продолжала увеличиваться по сравнению с предыдущим этапом исследования (табл. 29).
Таблица 29. Микрофлора содержимого зоба у цыплят-бройлеров, больных колибактериозом, через 15 суток после выздоровления, lg, КОЕ/г
| Микроорганизмы | Группа | ||
| контрольная | 1-я опытная | 2-я опытная | |
| Бифидобактерии | 7,53±0,20 | 8,44±0,07* | 8,43±0,06* |
| Лактобактерии | 7,30±0,17 | 7,61±0,09 | 7,67±0,14 |
| Эшерихии | 7,30±0,14 | 7,18±0,10 | 7,11±0,15 |
| Гемолитические | 3,95±0,13 | 3,26±0,28# | 3,62±0,23 |
| Сальмонеллы | 1,10±0,80 | 0,0±0,00 | 1,0±0,76 |
| Энтерококки | 3,46±0,37 | 2,20±0,80 | 3,32±0,30 |
Количество бифидо- и лактобактерий у цыплят 1-й и 2-й опытных групп было выше, чем у аналогов из контроля, соответственно на 12 и 11,9 (Р<0,05) и на 4,2 и 5 %, а эшерихий уменьшалось на 1,7 и 2,7 %, гемолитиче ских бактерий – на 21,2 (P<0,1) и 9,1, энтерококков – на 57,2 и 4,2. Сальмонелл у цыплят 1-й опытной группы не обнаружено, а у 2-й группы их количество уменьшилось по сравнению с аналогами из контроля на 10 % (рис.3).
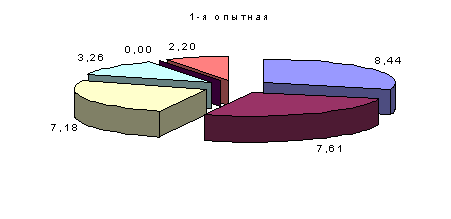

Рис. 3. Процентное соотношение микрофлоры в содержимом зоба через 15 суток после выздоровления.


 Рис. 4 Процентное соотношение микрофлоры в химусе слепых отростков до лечения.
Рис. 4 Процентное соотношение микрофлоры в химусе слепых отростков до лечения.
До применения пробиотика в химусе слепых отростков 30-суточных цыплят-бройлеров опытных и контрольной групп, больных колибактериозом, до лечения количество бифидобактерий, лактобактерий, эшерихий, гемолитических бактерий, сальмонелл и энтерококков было на одном уровне (табл.30, рис.4).
Таблица 30. Микрофлора химуса слепых отростков у цыплят-бройлеров, больных колибактериозом, до лечения, lg, КОЕ/г
| Микроорганизмы | Группа | ||
| контрольная | 1-я опытная | 2-я опытная | |
| Бифидобактерии | 7,70±0,17 | 7,70±0,15 | 7,71±0,11 |
| Лактобактерии | 7,48±0,17 | 7,49±0,10 | 7,46±0,10 |
| Эшерихии | 8,52±0,11 | 8,49±0,08 | 8,51±0,08 |
| Гемолитические | 4,93±0,15 | 4,92±0,12 | 4,90±0,12 |
| Сальмонеллы | 2,39±0,83 | 2,0±0,76 | 2,20±0,80 |
| Энтерококки | 4,03±0,31 | 4,03±0,28 | 4,09±0,26 |
На 5-е сутки после выздоровления отмечено изменение количества микрофлоры (табл. 31.рис. 5).



Рис. 5. Процентное соотношение микрофлоры в химусе слепых отростков через 5 суток после выздоровления.


Рис. 6. Процентное соотношение микрофлоры в химусе слепых отростков через 15 суток после выздоровления.
Таблица 31. Микрофлора химуса слепых отростков у цыплят-бройлеров, больных колибактериозом, на 5-е сутки после выздоровления, lg, КОЕ/г
| Микроорганизмы | Группа | ||
| контрольная | 1-я опытная | 2-я опытная | |
| Бифидобактерии | 7,64±0,17 | 8,37±0,08* | 8,34±0,05* |
| Лактобактерии | 7,40±0,19 | 7,88±0,13 | 7,74±0,16 |
| Эшерихии | 8,47±0,07 | 8,32±0,10 | 8,33±0,10 |
| Гемолитические | 4,68±0,16 | 4,18±0,20 | 4,21±0,17 |
| Сальмонеллы | 2,10±0,78 | 0,00±0,00 | 0,00±0,00 |
| Энтерококки | 3,74±0,21 | 3,55±0,21 | 3,63±0,21 |
Через 5 суток после выздоровления в химусе слепых отростков кишечника 40-суточных цыплят 1-й и 2-й опытных групп возросла численность бифидо- и лактобактерий относительно исходных данных соответственно на 8,7 и 8,2; 5,2 и 3,8 %, а эшерихий, гемолитических бактерий и энтерококков уменьшилась соответственно на 2 и 2,2; 17,7 и 16,4; 13,5 и 12,7 %, сальмонелл не обнаружено.
В контрольной группе относительно исходных данных уменьшилось содержание бифидобактерий, лактобактерий, эшерихий, гемолитических бактерий, сальмонелл и энтерококков соответственно на 0,8; 1,1; 0,6; 5,3; 13,8 и 7,8 %. По сравнению с аналогами из контроля у птицы 1-й и 2-й опытных групп возросла численность бифидо- и лактобактерий соответственно на 9,6 и 9,2 (P<0,05); 6,5 и 4,6 %, а количество эшерихий было меньше соответственно на 1,8 и 1,7, гемолитических – на 12 и 11,2, энтерококков – на 5,4 и 3 %. Сальмонеллы в химусе слепых отростков кишечника цыплят-бройлеров 1-й и 2-й опытных групп не обнаружены.
Содержание микрофлоры в химусе слепых отростков кишечника у подопытных цыплят, больных колибактериозом, через 15 суток после выздоровления представлено в табл. 32 рис.6.
Таблица 32. Микрофлора химуса слепых отростков у цыплят-бройлеров, больных колибактериозом, через 15 суток после выздоровления, lg, КОЕ/г
| Микроорганизмы | Группа | ||
| Контрольная | 1-я опытная | 2-я опытная | |
| Бифидобактерии | 7,51±0,19 | 8,32±0,07* | 8,30±0,06* |
| Лактобактерии | 7,33±0,21 | 7,89±0,11# | 7,77±0,15 |
| Эшерихии | 8,41±0,05 | 8,28±0,05 | 8,30±0,08 |
| Гемолитические | 4,52±0,16 | 4,08±0,20 | 4,09±0,24 |
| Сальмонеллы | 2,0±0,76 | 0,00±0,00 | 1,0±0,76 |
| Энтерококки | 3,68±0,33 | 3,42±0,40 | 3,62±0,33 |
Через 15 суток после выздоровления в химусе слепых отростков кишечника бройлеров опытных групп численность бифидобактерий снизилась, а лактобактерий продолжала увеличиваться по сравнению с предыдущим этапом исследования. У птицы контрольной группы исследуемые показатели были достоверно ниже, чем в опытных группах. Так, в 1-й и 2-й опытных группах количество бифидо- и лактобактерий было выше, чем у аналогов из контроля, соответственно на 10,8 и 10,5 (Р<0,05) и на 7,6 (P<0,1) и 6 %, а эшерихий было меньше соответственно на 1,6 и 1,3, гемолитических – на 10,8 и 10,5, энтерококков - на 7,6 и 1,7 %. Сальмонелл у цыплят 1-й опытной группы не обнаружено, а у 2-й группы их количество было меньше по сравнению с аналогами из контроля в 2 раза.
Следовательно, ветом 1.1 оказал ингибирующее действие на размножение в желудочно-кишечном тракте цыплят потенциальных патогенов.
Результаты исследований свидетельствуют, что с увеличением периода после выздоровления темп колонизации бифидобактериями желудочно-кишечного тракта цыплят-бройлеров снижался. Через 15 суток после выздоровления в содержимом зоба бройлеров опытных групп численность бифидобактерий снизилась, а лактобактерий продолжала увеличиваться по сравнению с предыдущим этапом исследования. Количество бифидо- и лактобактерий у цыплят 1-й и 2-й опытных групп было выше, чем у аналогов из контроля, соответственно на 12 и 11,9 (Р<0,05) и на 4,2 и 5 %, а количество эшерихий уменьшалось на 1,7 и 2,7 %, гемолитических бактерий – на 21,2 (P<0,1) и 9,1 %, энтерококков – на 57,2 и 4,2 %. Сальмонелл у цыплят 1-й опытной группы не обнаружено, а у 2-й группы их количество уменьшилось относительно исходных данных и по сравнению с аналогами из контроля на 10 %.
В химусе слепых отростков кишечника бройлеров опытных групп через 15 суток после выздоровления численность бифидобактерий также снизилась, а лактобактерий продолжала увеличиваться по сравнению с предыдущим этапом исследования. У птицы контрольной группы исследуемые показатели были достоверно ниже, чем в опытных группах. Так, в 1-й и 2-й группах количество бифидо- и лактобактерий было выше, чем у аналогов из контроля, соответственно на 10,8 и 10,5 (Р<0,05) и на 7,6 (P<0,1) и 6 %. Вместе с тем у цыплят 1-й и 2-й групп по сравнению с контролем эшерихий было меньше соответственно на 1,6 и 1,3 %, гемолитических – на 10,8 и 10,5 %, энтерококков – на 7,6 и 1,7 %. Сальмонелл у цыплят 1-й опытной группы не обнаружено, а во 2-й группе их количество было меньше по сравнению с аналогами из контроля в 2 раза.
Максимальный эффект получен при применении препарата в дозе 100 мг/кг массы 2 раза в сутки до выздоровления. У подопытных цыплят этой группы по сравнению с аналогами из 2-й группы через 5 суток после выздоровления в химусе слепых отростков количество бифидо- и лактобактерий было выше соответственно на 0,4 и 1,85 %, а эшерихий, гемолитических бактерий и энтерококков ниже на 0,1; 0,7 и 2,3 %. Наши данные согласуются с исследованиями А.Я. Шурыгина и соавт. (1996), Б.В. Тараканова и соавт. (1999), А.Н. Панина и соавт. (2000).
Следовательно, под влиянием ветома 1.1 более активно происходило размножение лакто- и бифидобактерий, препарат оказывал ингибирующее действие на размножение в желудочно-кишечном тракте цыплят-бройлеров потенциальных патогенов. Под влиянием препарата при колибактериозе ограничивается размножение в кишечнике цыплят потенциальных патогенов (эшерихий, сальмонелл, гемолитических бактерий), повышаются эффективность терапии, жизнеспособность и прирост живой массы птицы, сокращается продолжительность лечения.
Таким образом, ветом 1.1 обладает комплексным действием на организм цыплят-бройлеров. Мы считаем, что механизм действия ветома 1.1 обусловлен способностью Bacillus subtilis штамма ВКПМ - 7092 выживать в кислой среде, эффективно прикрепляться к эпителиоцитам слизистой стенки кишки и колонизировать ее, продуцировать антимикробные вещества, вызывать стимуляцию иммунной системы, подавлять рост и размножение патогенных микробов и восстанавливать нормальную микрофлору кишечника.
|
|
|


