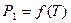|
растворов нелетучих веществ
|
|
|
|
Любое вещество в жидком состоянии затвердевает при температуре, при которой давление насыщенного пара над твёрдой и жидкой фазами этого вещества одинаково. Если разбавленный раствор содержит нелетучее растворённое вещество, то давление пара над раствором будет определяться только давлением пара растворителя. В этом случае раствор будет затвердевать при температуре, при которой давление насыщенного пара растворителя над жидкой и твёрдой фазами одинаково. Следствием закона Рауля является то, что разбавленные растворы нелетучих веществ затвердевают при более низкой температуре, чем чистый растворитель. Поскольку давление пара над раствором при прочих равных условиях всегда меньше, чем давление пара над чистым растворителем, то оно будет меньше давления пара над растворителем при температуре замерзания или давления пара над твёрдой фазой. Поэтому раствор не затвердеет при температуре замерзания чистого растворителя Т0. Для того чтобы давление пара над раствором стало равным давлению пара над чистым твёрдым растворителем, необходимо охладить раствор до температуры Т (Рисунок 8.2).
Тогда понижение температуры замерзания раствора составит:
ΔТзам = Т0 – Т (8.59)
Уравнение Клаузиуса – Клапейрона для процесса сублимации и испарения раствора можно за писать в виде:
 , (8.60)
, (8.60)
и
 Р
Р
|


Т0 – температура замерзания чистого растворителя;
Т – температура замерзания раствора.
Рисунок 8.2 - Понижение температуры замерзания раствора.
 , (8.61)
, (8.61)
где ΔНсуб - тепловой эффект процесса сублимации растворителя;
ΔНисп - тепловой эффект процесса испарения растворителя.
|
|
|
Для температуры замерзания раствора, когда при замерзании в твёрдую фазу переходит чистый растворитель, можно записать:
Р1(ж) = Р  = Р
= Р  и Р1(тв) = Р1, (8.62)
и Р1(тв) = Р1, (8.62)
где Р  - давление растворителя над чистым жидким растворителем;
- давление растворителя над чистым жидким растворителем;
Р1 - давление пара растворителя над раствором.
Тогда, вычитая из уравнения (8.60) уравнение (8.61), получим:

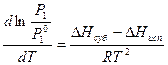 , (8.63)
, (8.63)
где ΔНсуб – ΔНисп = ΔНпл – теплота плавления чистого растворителя.
Из закона Рауля для растворителя следует, что
 = Х1, (8.64)
= Х1, (8.64)
где Х1 – молярная доля растворителя в растворе.
Тогда уравнение (8.63) примет вид:
 (8.65)
(8.65)
или
 (8.66)
(8.66)
Проинтегрируем уравнение в пределах состояний чистый растворитель – раствор:
 (8.67)
(8.67)
Откуда получим:
lnX1 = - 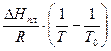 (8.68)
(8.68)
После преобразований можно записать:
lnX1 = - 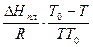 = -
= - 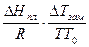 (8.69)
(8.69)
Если молярная доля растворённого нелетучего вещества в разбавленном растворе равна Х2, то должно выполняться неравенство Х1 >> X2. Поскольку
Х1 + Х2 = 1, то уравнение (8.69) можно записать в виде:
ln(1- Х2) = - 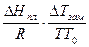 (8.70)
(8.70)
Поскольку Т0 незначительно отличается от Т, то без большой погрешности можно допустить, что Т ∙ Т0 = Т  . Тогда уравнение (8.70) можно записать в виде:
. Тогда уравнение (8.70) можно записать в виде:
ln(1- Х2) = -  (8.71)
(8.71)
Величина ln(1 – X2) может быть разложена в ряд:
ln(1 – X2) = - X2 -  (8.72)
(8.72)
Если Х2 ≤ 0,02, то с точностью до 1% в уравнении (8.72) можно ограничиться только первым членом. Тогда уравнение (8.71) примет вид:
Х2 =  (8.73)
(8.73)
Преобразуя, получим уравнение для повышения температуры кипения разбавленного раствора нелетучего вещества:
ΔТзам =  (8.74)
(8.74)
Если разбавленный раствор состоит из n1 молей растворителя и n2 молей растворённого вещества, то молярная доля растворённого вещества определится уравнением:
Х2 =  (8.75)
(8.75)
или
Х2 =  =
=  (8.76)
(8.76)
где g1 – масса растворителя;
М1- молекулярный вес растворителя.
Если g1 = 1000г, то n2 будет представлять число молей растворённого вещества, приходящихся на 1000г растворителя, т.е. моляльную концентрацию (b2) растворённого вещества. Тогда связь между моляльной концентрацией и молярной долей растворённого вещества в растворе будет выражаться уравнением:
|
|
|
Х2 =  (8.77)
(8.77)
С учётом уравнения (8.77) уравнение (8.74) примет вид:
ΔТзам =  (8.78)
(8.78)
После преобразований получим:
ΔТзам =  =
=  , (8.79)
, (8.79)
где λпл = 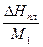 – удельная теплота плавления чистого растворителя,
– удельная теплота плавления чистого растворителя, 
b2 – моляльная концентрация растворённого вещества.
Выражение  представляет собой криоскопическую постоянную Кзам растворителя:
представляет собой криоскопическую постоянную Кзам растворителя:
Кзам =  (8.80)
(8.80)
Криоскопическая постоянная характеризует природу растворителя, так как в неё входят свойства физические чистого растворителя: температура плавления и удельная теплота плавления. Криоскопическая постоянная представляет собой понижение температуры замерзания раствора, в котором моляльная концентрация растворённого вещества равна единице, при условии, что раствор сохраняет свойства разбавленного раствора.
С учётом уравнения (8.80) уравнение (8.79) примет вид:
ΔТзам =Кзамb2 (8.81)
В уравнение (8.81) не входят физико – химические свойства растворённого вещества. Это означает, что понижение температуры замерзания не должно зависеть от природы растворённого вещества.
Таким образом, понижение температуры замерзания разбавленных растворов нелетучих веществ зависит от природы растворителя, концентрации растворённого вещества и не зависит от природы растворённого вещества.
Моляльную концентрацию растворённого вещества можно представить в виде уравнения:
b2 =  , (8.82)
, (8.82)
где g2 – масса растворённого вещества;
g1 – масса растворителя;
М2 – молекулярный вес раствор1нного вещества.
Сопоставляя уравнения (8.81) и (8.82), получим:
М2 =  (8.83)
(8.83)
Таким образом, измерение понижения температуры замерзания разбавленного раствора позволяет определить молекулярный вес нелетучего растворённого вещества. Метод определения молекулярного веса растворенного вещества с помощью измерения температуры замерзания раствора называется криоскопией.

|
|
|



 2 -
2 -  3 -
3 -