 |
Процесс распада электролита на ионы называется электролитической диссоциацией.
|
|
|
|
Возвращаясь к языку химических уравнений, запишем две полуреакции:
Cu2++2е=Cu
SO42--2e=SO4
Одна из них, сопровождающаяся отщеплением электронов, является окислительной, а другая, связанная с поглощением электронов, восстановительная.
Электрод, подключённый к отрицательному полюсу и на котором идёт восстановление (поглощение электронов), называется катодом. Анод – электрод, подключённый к положительному полюсу и на котором идёт окисление (отщепление электронов).
Окислительно-восстановительными называются химические реакции, в ходе которых происходит изменение степеней окисления атомов или групп атомов. Степень окисления – это формальный заряд атома в веществе. Например, для меди степень окисления +2, для алюминия +3.
В проводниках первого рода ток переносят электроны (металлы, полупроводники), в проводниках второго рода – ионы (растворы и расплавы электролитов).
Электродом называется проводник первого рода, контактирующий с проводником второго рода.
Полуреакции, протекающие на границе проводник первого рода – проводник второго рода (электролит) с участием электронов, называются электрохимическими реакциями. Эти реакции протекают на такой границе, на которой электронная проводимость электрического тока заменяется ионной проводимостью.
Ионы разных знаков при встрече могут снова объединиться в нейтральные молекулы – рекомбинировать, то есть при электролизе окислительно-восстановительная реакция может протекать в любом направлении и носить обратимый характер.
Взвешивая катод до и после опыта (см. рисунок), можно точно определить массу осадившегося металла. Измерения показывают, что масса вещества, выделившегося на электроде, зависит от силы тока и времени электролиза:
|
|
|
M=κ ·I·t,
где М – масса вещества, претерпевшего превращение
I - сила тока, проходящего через границу раздела
t - продолжительность прохождения тока (электролиза)
κ – коэффициент пропорциональности, называемый электрохимическим эквивалентом и показывающий, какое количество вещества претерпело превращение при прохождении через границу единицы количества электричества.
| Вещество | κ в мг/Кл |
| Серебро, Ag Водород, H Углерод С Медь, Cu Цинк, Zn Алюминий, Al | 1, 118 0, 01045 0, 299 0, 3294 0, 3388 0, 3356 |
Первый закон Фарадея. Масса вещества, выделившегося на электроде, прямо пропорциональна заряду (количеству электричества), прошедшему через электролит (через границу).
На основании многочисленных опытов Фарадей пришёл к выводу, что электрохимический эквивалент является величиной, характерной для каждого вещества. Так, например, при электролизе раствора азотнокислого серебра AgNO3, 1 кулон (1Кл=1/3600А·час) выделяет 1, 1180 мг серебра. Точно такое же количество серебра выделяется при электролизе зарядом 1 Кл любой другой серебряной соли. При электролизе соли другого металла 1Кл выделяет другое количество данного металла. Таким образом, электрохимическим эквивалентом какого-либо вещества называется масса этого вещества, выделяемая при электролизе 1 кулоном протекшего через электролит электричества.
Из таблицы видно, что эти значения электрохимических эквивалентов для некоторых веществ существенно отличаются один от другого.
Для измерения количеств веществ, участвующих в химических реакциях, выбрана особая единица – моль. Чтобы отмерить один моль вещества, нужно взять столько граммов его, какова его относительная молекулярная масса. Например, 1 моль воды (Н2О) равен 18 граммам (1+1+16=18), моль кислорода О2 – 32 грамма (16+16=32), моль железа Fe – 56 граммов, алюминия Al – 27 граммов.
|
|
|
Один моль NaF = 23+17 = 40г. Один моль AlF3 = 27 + 17 +17 +17 = 78 г.
Особенно важно, что 1 моль любого вещества всегда содержит одинаковое число молекул.
Моль – это количество вещества, в котором содержится 6·1023 молекул этого вещества. Это число (N) называют числом Авогадро или постоянной Авогадро: N=6·1023моль-1.
Окислительно-восстановительные реакции в гальванических элементах протекают самопроизвольно, электрический ток является следствием химической реакции. При электролизе же наоборот – процесс химического превращения требует затраты электроэнергии, то есть электрический ток вызывает химическую реакцию. Поэтому справедливо определение – электролизом называется процесс химического превращения, происходящего в результате действия электрического тока.
Свойства алюминия и его сплавов
Алюминий представляет собой серебристо-белый металл с синеватым оттенком. Уникальное сочетание его свойств – малая плотность, высокая тепло- и электропроводность, коррозионная стойкость, хорошая механическая прочность в сочетании с высокой пластичностью – обеспечили широкое применение, как чистого металла, так и сплавов на его основе.
Благодаря малой плотности алюминия (2, 7 г/см3), сплавы на его основе в 2 – 3 раза легче стали, хорошо поддаются механической обработке, а по прочности не уступают среднелегированным сталям. Алюминий и его сплавы хорошо противостоят атмосферной коррозии, так как покрыты тонкой (2·10-5 см), но плотной окисной плёнкой, препятствующей допуск кислорода к металлу.
 Порядковый номер Al в периодической системе Д. И. Менделеева 13, его атомная масса составляет 26, 98. Al трёхвалентен и его 13 электронов расположены на оболочках: 1s2, 2s2, 2p6, 3s2, 3p1. Ядро состоит из 14 нейтронов и 13 протонов. На внешнем электронном слое находятся три валентных электрона: два на 3s-орбите и один на 3p-орбите. Поэтому в химических соединениях Al обычно трёхвалентен, но при высоких температурах устойчивы и одновалентные соединения (субсоединения).
Порядковый номер Al в периодической системе Д. И. Менделеева 13, его атомная масса составляет 26, 98. Al трёхвалентен и его 13 электронов расположены на оболочках: 1s2, 2s2, 2p6, 3s2, 3p1. Ядро состоит из 14 нейтронов и 13 протонов. На внешнем электронном слое находятся три валентных электрона: два на 3s-орбите и один на 3p-орбите. Поэтому в химических соединениях Al обычно трёхвалентен, но при высоких температурах устойчивы и одновалентные соединения (субсоединения).
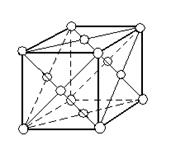
Кристаллическая решётка Al – гранецентрированный куб, которая устойчива при температуре от 4˚ К до температуры плавления. Примеси в Al незначительно влияют на параметры решётки. Удельное электросопротивление алюминия чистотой 99, 996% при температуре 20˚ С составляет 2, 6548·10-8 Ом·м, теплопроводность в твёрдом состоянии снижается по мере роста температуры. Температура плавления очень чувствительна к чистоте металла и для алюминия чистотой 99, 996% составляет 660, 3˚ С, а температура начала кристаллизации 660, 37˚ С. Температура кипения Al около 2494˚ С.
|
|
|
| Марка | Алюминий, не менее | Примеси, не более | ||||||
| Железо | Кремний | Медь | Цинк | Титан | Прочие | СУММА | ||
| Алюминий особой чистоты | ||||||||
| А999 | - | - | - | - | - | - | - | 0, 001 |
| Алюминий высокой частоты | ||||||||
| А995 | 99, 995 | 0, 0015 | 0, 001 | 0, 001 | 0, 001 | 0, 001 | 0, 001 | 0, 005 |
| А99 | 99, 99 | 0, 003 | 0, 003 | 0, 003 | 0, 003 | 0, 002 | 0, 001 | 0, 010 |
| Алюминий технической частоты | ||||||||
| А85 | 99, 85 | 0, 08 | 0, 06 | 0, 01 | 0, 02 | 0, 01 | 0, 02 | 0, 15 |
| А8 | 99, 80 | 0, 12 | 0, 10 | 0, 01 | 0, 04 | 0, 02 | 0, 02 | 0, 20 |
| А7 | 99, 70 | 0, 16 | 0, 16 | 0, 01 | 0, 04 | 0, 02 | 0, 02 | 0, 30 |
| А7Э | 99, 70 | 0, 20 | 0, 10 | 0, 01 | 0, 03 | 0, 04 | 0, 03 | 0, 30 |
| А0 | 99, 0 | 0, 50 | 0, 50 | 0, 02 | 0, 08 | 0, 03 | 0, 03 | |
Механические свойства Al зависят от количества примесей. С увеличением их содержания пластичность уменьшается, а прочностные свойства растут. Качество Товарного алюминия регламентирует ГОСТ 11069-74, а алюминий марки А7Э, который является базовым на Лондонской бирже металлов (LME), выпускается в соответствии с ТУ-48-5-287-67. В таблице приведены выдержки из указанных стандартов, характеризующие химический состав алюминия различных марок.
Подавляющее количество алюминия используется в виде сплавов, которые, в зависимости от применения, делятся на две большие группы – деформируемые (около 80%) и литейные (около 20%).
Деформируемые сплавы предназначены для производства изделий давлением (прокатка, штамповка, волочение). Для придания изделиям определённых свойств сплавы легируют различными элементами (Cu, Mn, Si, Mg, Zn и др. ). Деформируемые сплавы подразделяют на два основных класса: неупрочняемые и термически упрочняемые. Литейные сплавы используют для получения различных отливок путём литья под давлением, в кокиль, в песчаные формы, литья по выплавляемым моделям и пр.
|
|
|
Наибольшее распространение получили сплавы типа дуралимина, содержащие 3 -5 % Cu, 0, 5 – 15 % Mg, 0, 4 – 0, 8 % Mn. Эти добавляемые к алюминию металлы способствуют сильному упрочнению сплава после закалки и старения. Сплавы алюминия с кремнием ( 4 – 13 % Si) называются силуминами. Эти лёгкие сплавы (2, 6 – 2, 7 г/см3) жидкотекучи, прочны и коррозионностойки. Благодаря хорошим литейным свойствам силумины используют для тонкостенного и точного литья ответственных деталей машин и приборов.
Алюминий - лидер среди конструкционных материалов в самолётостроении. Около 75% деталей изготовлено из сплавов алюминия. Армирование этих сплавов волокнами бора, бериллия или стекла придаёт конструкциям особую жесткость, позволяющую применять их для наиболее нагруженных частей сверхзвуковых самолётов.
Сплавы алюминия широко используются также в наземном и морском транспорте. Алюминиевая обшивка морских судов в десятки раз более коррозионноустойчива, чем обшивка из стали.
Тонкий слой алюминия способен надёжно предохранять от коррозии стальную конструкцию. Наносится алюминий на сталь методом горячего напыления. Суть его состоит в том, что стальная деталь обдувается струёй раскалённого инертного газа, туман из капель алюминия. Например, стальные фермы с алюминиевым напылением составляют подводную часть буровых установок для добычи нефти в море.
За последние десятилетия резко возросло применение алюминия для производства товаров широкого потребления – пылесосы, стиральные и посудомоечные машины, холодильники, вентиляторы, предметы кухонной утвари, утюги и пр. И масштабы потребления алюминия для этих целей растут постоянно.
Для производства тары, необходимой, в основном для упаковки продуктов, расходуется не только фольга, но и слоистые материалы, в качестве которых плёнки из целлофана, ацетата целлюлозы, гидрохлорида каучука, поливинилхлорида, полиэфира и полиэтилена.
Особое значение имеет применение алюминия в военной технике.
Основы электролиза криолитоглинозёмных расплавов
Электролиз криолито-глинозёмных расплавов является основным способом получения алюминия.
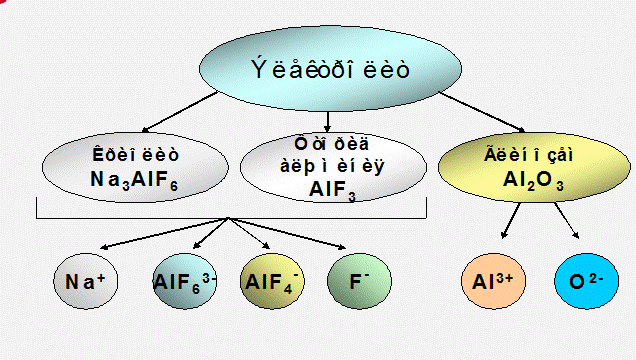
В основе электролитического производства алюминия лежит электролиз криолито-глинозёмных расплавов, основными компонентами которых являются: криолит (Na3AlF6), фтористый алюминий (AlF3) и глинозём (Al2O3).
Основной частью электролита служит криолит(Na3AlF6), который является наилучшим растворителем глинозёма(Al2O3). Различные добавки к электролиту изменяют его физико-химические свойства и влияют на технологические параметры работы электролизёра. Необходимыми добавками, используемыми в промышленности, являются фтористый алюминий AlF3 (от 2 до 14% масс) и фтористый кальций CaF2 (до 8% масс). Обе эти добавки снижают точку плавления электролита.
|
|
|
Температура электролита при нормальном технологическом режиме электролиза от 950˚ С до 965˚ С.
Основным агрегатом является электролизёр. Первые промышленные электролизёры были рассчитаны на силу тока 0, 6 кА, и за последние 100 лет она возросла до 400 кА. Тем не менее, это не внесло существенных изменений в основы производственного процесса.
Существует два основных типа расходуемых угольных анодов: самообжигающиеся и предварительно обожжённые. Расплавленный алюминий при температуре электролиза (950-960°С) тяжелее электролита и находится на подине электролизёра. Криолитоглинозёмные расплавы очень агрессивны, противостоять им могут углеродистые и некоторые новые материалы. Из них и выполняется внутренняя футеровка электролизёра. Для преобразования переменного тока в постоянный применяются полупроводниковые выпрямители, установленные в кремниевой преобразовательной подстанции (КПП). Один выпрямительный агрегат даёт ток силой до 63 кА. Число их зависит от необходимой силы тока, так как все они включены параллельно.
Процесс, протекающий в электролизёре, состоит в электролитическом разложении глинозёма, растворённого в электролите. На жидком алюминиевом катоде выделяется алюминий, который периодически выливается вакуум-ковшами и отправляется в литейное отделение. На аноде происходит окисление углерода выделяющимся кислородом. Отходящий анодный газ представляет собой смесь СО2 и СО.
Глинозём, при растворении в криолите, диссоциирует на катионы Al3+ и анионы O2-.
На границе раздела алюминий-электролит протекает реакция восстановления ионов трёхвалентного алюминия.
|
|
|


