 |
Основные характеристики растворов
|
|
|
|
Растворы занимают промежуточное положение между химическими соединениями постоянного состава и механическими смесями.
Раствор – гомогенная система переменного состава, состоящая из двух или более компонентов.
Растворы бывают:
1) твёрдыми – твёрдые растворы или сплавы (например, сплав серебра и золота);
2) газообразными – газообразные растворы или смеси газов (например, смесь азота и кислорода);
3) жидкими – могут быть построены по типу жидкость - газ, жидкость - жидкость, жидкость - твёрдое вещество (например, водный раствор сахара, кровь, водный раствор поваренной соли).
Отсутствие у растворов постоянного состава, неприменимость к ним законов эквивалентов и кратных отношений сближает их с механическими смесями. Но однородность, тепловые и объёмные эффекты – сближают с химическими соединениями.
Способы выражения состава растворов.
На практике состав растворов выражают с помощью следующих величин:
а) безразмерных – массовая и мольная доли;
б) размерных – молярная концентрация вещества, молярная концентрация вещества эквивалентов, моляльность.
Основные способы выражения концентрации растворов приведены в таблице 2.
Растворимость
Растворимость – это способность вещества растворяться в том или ином растворителе.
Мерой растворимости вещества при данных условиях является его содержание в насыщенном растворе, т.е. там, где установилось равновесие между раствором и веществом, которое осталось нерастворённым.
Таблица 2
Основные способы выражения концентрации растворов
| Вид концентрации | Математическая формула | Пример |
Массовая доля растворенного вещества - это есть отношение массы растворенного вещества (  ) к массе раствора ( ) к массе раствора (  ). ).
|  (51)
следует учесть, что (51)
следует учесть, что
 (52) (52)
 (53)
где mв-ва – масса растворенного
вещества (г);
mр-ра – масса раствора (г);
rр-ра – плотность раствора (г/мл);
Vр-ра – объем раствора (мл). (53)
где mв-ва – масса растворенного
вещества (г);
mр-ра – масса раствора (г);
rр-ра – плотность раствора (г/мл);
Vр-ра – объем раствора (мл).
| 4,8 г H2SO4 содержится в 24 г
раствора. Тогда

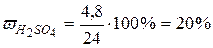 то есть в 100 г раствора содержится 20 г серной кислоты.
то есть в 100 г раствора содержится 20 г серной кислоты.
|
| Молярная концентрация растворенного вещества (или молярность) –это отношение количества моль растворенного вещества (n) к объему раствора (V) или число моль растворенного вещества в 1 литре раствора. |  (54) (моль/л) (54) (моль/л)
 (55)
где mв-ва – масса растворенного вещества (г);
Мв-ва – молярная масса
растворенного вещества (г/моль);
V - объем раствора (л) (55)
где mв-ва – масса растворенного вещества (г);
Мв-ва – молярная масса
растворенного вещества (г/моль);
V - объем раствора (л)
| В 500 мл раствора содержится
28 г KOH. Тогда
 то есть в 1 литре раствора содержится 0,1 моль гидроксида калия.
то есть в 1 литре раствора содержится 0,1 моль гидроксида калия.
|
| продолжение таблицы 2 | ||
| Вид концентрации | Математическая формула | Пример |
| Молярная концентрация эквивалента растворенного вещества – это есть отношение количества эквивалентов (числа моль эквивалентов) растворенного вещества (nэкв) к объему раствора (V) (или число моль эквивалентов растворенного вещества в 1 литре раствора). |  (56) (мольэкв/л) (56) (мольэкв/л)
 (57)
где mв-ва – масса растворенного вещества (г); (57)
где mв-ва – масса растворенного вещества (г);  – молярная масса эквивалентов растворенного вещества (г/мольэкв); V – объем раствора (л) – молярная масса эквивалентов растворенного вещества (г/мольэкв); V – объем раствора (л)
| В 100 мл раствора содержится 0,365 г HCl. Тогда
 то есть в 1 литре раствора содержится 0,1 моль эквивалентов соляной кислоты.
то есть в 1 литре раствора содержится 0,1 моль эквивалентов соляной кислоты.
|
| Моляльная концентрация (или моляльность) – это есть количество моль растворенного вещества (n) в 1 кг растворителя (или в 1000 г растворителя). |  (58)
(моль/кг) (58)
(моль/кг)
 (59)
где mв-ва – масса растворенного вещества (г); Мв-ва – молярная масса растворенного вещества (г/моль);
mр-ля – масса растворителя (кг). (59)
где mв-ва – масса растворенного вещества (г); Мв-ва – молярная масса растворенного вещества (г/моль);
mр-ля – масса растворителя (кг).
| В 500 г воды (т.е. растворителя) содержится 40 г NaOH.
Тогда
 то есть в 1 кг воды
содержится 2 моль NaOH.
то есть в 1 кг воды
содержится 2 моль NaOH.
|
| продолжение таблицы 2 | ||
| Вид концентрации | Математическая формула | Пример |
| Молярная доля растворенного вещества – это отношение количества моль растворенного вещества к сумме количеств (к сумме моль) всех веществ, составляющих раствор. |  (60)
где nв-ва – количество моль
растворенного вещества (моль);
nр-ля – количество моль растворителя (моль). (60)
где nв-ва – количество моль
растворенного вещества (моль);
nр-ля – количество моль растворителя (моль).
|
49 г H2SO4 растворено
в 36 г воды. Тогда


 то есть молярная доля H2SO4 в растворе равна 0,2.
то есть молярная доля H2SO4 в растворе равна 0,2.
|
|
|
|
|
|
|
В зависимости от содержания растворённого вещества раствор может быть:
1. насыщенным – это раствор, который находится в равновесии с твёрдой фазой растворённого вещества и содержит максимально возможное при данных условиях количество этого вещества;
2. ненасыщенным – это раствор, концентрация вещества в котором ниже концентрации насыщенного раствора, т.е. ниже его растворимости;
3. пересыщенным – это раствор, в котором содержится вещества больше, чем определяется его растворимостью.
Количественно растворимость выражается коэффициентом растворимости – это масса вещества, способного растворяться в 100 г растворителя при данной температуре.
Для газов иногда коэффициент растворимости выражают в миллилитрах газа, способного раствориться в 1000 г растворителя (или в 1 л растворителя) при данной температуре и давлении.
Растворимость вещества зависит:
1. от природы растворенного вещества и природы растворителя (в этом случае полярные вещества (НС1, NaCl) лучше растворяются в полярных растворителях (вода), а неполярные вещества лучше растворяются в неполярных или малополярных растворителях);
2. от температуры (с повышением температуры путем нагревания растворимость большинства твердых веществ, как правило, увеличивается, растворимость газов (Н2, O2) в воде с повышением температуры уменьшается);
3. от давления (для растворимости газов)
|
|
|


