 |
Контрольні питання.. 6.2. Лінійчаті спектри атомів в газах.
|
|
|
|
Контрольні питання.
- Дати визначення і пояснити фізичний зміст потоку енергії.
- Дати визначення і пояснити фізичний зміст енергетичної світимості тіла, яке випромінює.
- Які характеристики називаються “спектральними” і від чого вони залежать?
- Чому при випромінювальному теплообміні кажуть про “рівноважні умови”?
- Що таке модель абсолютно чорного тіла?
- Чому досліди, які приводять до функції Кірхгофа, виявились такими важливими для побудови квантової теорії теплового випромінювання?
- Які випромінювачі називаються “сірими” і як визначається ступінь чорноти?
- Сформулювати і записати основні закони теплового випромінювання для абсолютно чорного тіла.
- Що було основним фактором, який відрізняє формулу Планка від спроб хвильової інтерпретації законів для абсолютно чорного тіла?
6. 2. Лінійчаті спектри атомів в газах.
Спектри випромінювання і поглинання, одержувані в розріджених газах, складаються з набору ліній, спостережуваних при певних частотах n і довжинах хвиль: 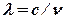 , де с @ 3·108 м/с. Цим вони відрізняються від неперервних спектрів, одержуваних в більш щільних середовищах, таких, як рідина, наприклад. Оскільки в розріджених газах атоми розділені значними відстанями і порівняно слабко впливають один на одного, можна зробити висновок, що лінійчаті спектри відбивають властивості окремих атомів.
, де с @ 3·108 м/с. Цим вони відрізняються від неперервних спектрів, одержуваних в більш щільних середовищах, таких, як рідина, наприклад. Оскільки в розріджених газах атоми розділені значними відстанями і порівняно слабко впливають один на одного, можна зробити висновок, що лінійчаті спектри відбивають властивості окремих атомів.
На початку становлення квантової фізики існував ряд моделей внутрішнього устрою атомів, з яких лише модель, запропонована Резерфордом і названа “планетарною”, могла вважатись порівняно обґрунтованою, так як вона відповідала експериментальним даним про розсіяння a-частинок. Недоліком моделі була відсутність фізичного з’ясування сталості атомів, здатних випадковим чином випромінювати електромагнітні хвилі і, як наслідок, втрачати енергію. Найти рішення цієї задачі було запропоновано Резерфордом молодому фізику Бору, який стажувався в його лабораторії. Результатом рішення повинна була служити теоретична інтерпретація ( на основі моделі атома водню) лінійчатого спектра газоподібного водню, експериментально вивченого і надійно описаного Бальмером задовго до цього моменту:
|
|
|
 (6. 23)
(6. 23)
де стала Рідберга: R = 1, 097·107 м-1 була підігнана під дослідні дані, а n1 = 2 i n2 = 3, 4, 5, …були цілими числами. Незвичайна особливість цієї формули, яка описує діапазон хвиль, що відповідають видимому світлу, полягає в тому, що при заміні: n1 = 2 на n1 = 1 і n2 = 2, 3, 4, …, а також на n1 = 3 і n2 = 4, 5, 6, … і т. ін., виникають додаткові серії ліній в інфрачервоних і ультрафіолетових областях спектра, згодом найдені експериментально. Таким чином, Бор мав з’ясувати смисл цих ліній в рамках моделі атома водню, а також виразити сталу Рідберга R, як це було зроблено для сталих s, b1, b2 в законах теплового випромінювання, через відомі фундаментальні константи.
Для виконання такої задачі Бор, спираючись на гіпотезу квантів Планка, сформулював два основних постулати, яким повинна була підкорятись поведінка електрона, який рухається по коловій орбіті в полі кулонівського тяжіння, створюваного ядром воднеподібного атома.
1. Електрон в атомі може знаходитись не в будь-яких станах ( не на будь-яких орбітах), а тільки в таких (дозволених), де його момент імпульсу складається з цілого числа значень n сталої Планка:
 . (6. 24)
. (6. 24)
Тут n = 1, 2, 3,..., ¥ - номер орбіти, m = 9, 1·10-31 кг – маса електрона, un – його швидкість, а rn – радіус колової орбіти.
В таких квантових станах електрона атом водню не випромінює і не поглинає електромагнітні хвилі і його повна енергія залишається сталою.
|
|
|
2. При переході електрона із одного дозволеного стану в інший стан атом водню поглинає або випромінює квант енергії, який дорівнює різниці повних енергій електрона в цих станах:
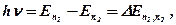 (6. 25)
(6. 25)
де n - частота випромінювання, hn - енергія фотона.
Рівноважний стан електрона в кожному квантовому стані зрозумілий із рівняння, яке стверджує, що доцентрова кулонівська сила взаємодії електрона з ядром урівноважується відцентровою силою інерції обертання:
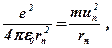 (6. 26)
(6. 26)
де e = 1, 6·10-19 Кл – модуль заряда електрона і ядра (протона) в атомі водню,
e о = 8, 85·10-12 Ф/м – електрична стала.
Із (6. 24) і (6. 26) Н. Бор одержав вираз для радіусів дозволених орбіт і швидкостей електрона на них:
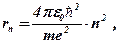 (6. 27)
(6. 27)
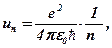 (6. 28)
(6. 28)
а також значення кінетичної, потенціальної та повної енергії у кожному квантовому стані:
 (6. 29)
(6. 29)
Зрозуміло, що ці енергії, швидкості і радіуси квантовані, тобто залежать виключно від значення номера орбіти n, яке, згодом, було назване “головним квантовим числом”. Квантове число n назване “головним” не тільки тому, що воно визначає найважливішу характеристику стану – повну енергію, але і тому, що мають місце і інші квантові числа, які визначають квантування орбітальних механічного і магнітного моментів електрона.
Підставляючи два значення енергій різних орбіт n1 i n2 (7) в формулу (3), Бор одержав енергію кванта:
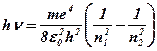 (6. 30)
(6. 30)
і, відповідно, обернену довжину хвилі:
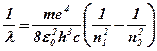 . (6. 31)
. (6. 31)
Тим самим була підтверджена структура формули Бальмера (1), встановлений фізичний зміст чисел n1 i n2, а також стала Рідберга із (1) виражена через фундаментальні сталі:
 . (6. 32)
. (6. 32)
Теорія атома водню, створена Бором, припускала, що орбіти по яким рухається електрон є коловими. Це припущення не підтвердилось при подальшому розвитку квантової фізики. З рішення точного рівняння Шредінгера випливало, що поняття траєкторії електрона взагалі слід замінити поняттям “імовірнісної хмари”, всередині якої десь знаходиться ця частинка. Форма такої хмари для малих значень n може бути найдена досить точно і являє собою “гантель”, “осімку” і т. ін. Звідси, із зростанням n розміри атома зростають зовсім не так швидко, як то витікає з формули (6. 28). Разом з тим, теорія Бора з дивовижною точністю передбачила значення характеристик першої (яка називається “незбудженою”) і дійсно колової орбіти електрона в атомі водню, тобто величин, одержуваних з (6. 25, 6. 26, 6. 27) при n =1. Для енергетичних одиниць в квантовій фізиці поряд з джоулем використовують величину, яку називають “електрон-вольтом” (1еВ = 1. 6 10-19 Дж). Подібним чином, поряд з метром, відстані в мікросвіті електронів, ядер, атомів і
|
|
|
т. ін. прийнято вимірювати за допомогою величини, яка називається “ангстремом” (1Å = 1× 10-10м).
Незважаючи на певні недоліки, а також суміш класичних і квантових уявлень, використаних при побудові теорії атома водню, модель, запропонована Бором, є одним з основних етапів розвитку квантової фізики.
|
|
|


