 |
Исследование включает ряд показателей.
|
|
|
|
СИСТЕМНЫЕ ВАСКУЛИТЫ
Системные васкулиты - группа болезней, при которых ишемия и некроз тканей возникают вследствие воспаления кровеносных сосудов первичного (системные васкулиты) или вторичного характера (при системных поражениях соединительной ткани, инфекции, опухоли и др.).
ЭПИДЕМИОЛОГИЯ
Распространённость системных васкулитов колеблется от 0,4 до 14 и более случаев на 100000 населения. Эти заболевания относят к числу сравнительно редких, однако в последние годы отмечена тенденция к увеличению их распространённости, особенно микроскопического полиангиита и гранулематоза Вегенера.
Системные васкулиты чаще встречаются у мужчин, чем у женщин; могут развиваться в любом возрасте, но преимущественно в 30-50 лет, за исключением геморрагического васкулита и болезни Кавасаки, для которых характерно начало болезни в детском и юношеском возрасте. Пик заболеваемости васкулитами приходится на зиму и весну.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Этиология васкулитов остается невыясненной. Продолжается изучение взаимосвязей между генетическими маркерами и развитием данной группы заболеваний. Установлены существенные различия в распространенности некоторых форм СВ (гигантоклеточный артериит, артериит Такаясу, болезнь Бехчета (ББ), болезнь Кавасаки (БК)) в различных этнических группах. Имеются данные о возникновении СВ (узелкового полиартериита, гигантоклеточного артериита, артериита Такаясу, болезни Бехчета) у членов одной семьи, в том числе у однояйцовых близнецов. Выявлена связь между носительством определенных антигенов главного комплекса гистосовместимости и развитием системных васкулитов. Например, обнаружена высоокая частота встречаемости HLA антигенов А1, В8, В9, В5, В7; DRW2 - у больных облитерирующим тромбангиитом; А10, В5, BW52 - при болезни Такаясу; DRW2 - у больньгх синдромом Гудпасчера (СГ); А2; В44, CW5 - у пациентов с синдромом Кавасаки.
|
|
|
В качестве этиологических факторов рассматриваются также инфекционные агенты:
· вирус гепатита А, В, С;
· микобактерии туберкулеза и лепры;
· обсуждается роль в развитии васкулитов вирусов Коксаки В2 и В6, человеческого сывороточного парвовируса, цитомегаловируса, вируса простого герпеса, а также бактериальной инфекции (стрептококк, стафилококк, риккетсии, легионелла).
· паразитарная (аскаридоз, стронгидоидоз и филяриатоз и др.) и грибковая инфекции.
Большинство исследователей считают, что наибольшую значимость имеют вирусы гриппа А, В, кори, краснухи, герпеса, Эпштейна - Барр, гепатита В и С, а также цитомегаловирус, микоплазма и хламидии. Можно полагать, что данные инфекционные агенты выполняют триггерную роль в запуске иммуновоспалительного процесса в сосудистой стенке при целом ряде вариантов СВ. Наиболее часто инфекция вызывает васкулит мелких сосудов кожи, обычно лейкоцитокластический кожный васкулит или геморрагический васкулит (ГВ), узловатую эритему, реже доброкачественный уртикарный васкулит с гипокомплементемией. Более чем у половины больных с ГВ началу заболевания предшествует инфекция верхних дыхательных путей. Косвенным подтверждением участия инфекции в развитии системных васкулитов служит обнаружение гранулем в сосудистой стенке, что может отражать индуцированную инфекцией Т- клеточную гиперчувствительность (гранулематоз Вегенера (ГрВ), артериит Такаясу), а также сезонные колебания заболеваемости некоторыми васкулитами (ГрВ, ГВ) и наличие эпидемических вспышек (БК). Предполагается, что многие инфекционные агенты могут быть причинными (или триггерными) факторами, инициирующими воспаление сосудов различного калибра. Определённая роль в этиологии системных васкулитов отводится длительному контакту пациентов с кремнием, металлами (бронза, латунь), однако чёткой взаимосвязи между этими факторами и возникновением СВ не обнаружено. Повышенная чувствительность к компонентам табака, как полагают, бывает причиной облитерирующего тромбангиита.
|
|
|
Васкулиты могут развиваться на фоне ДБСТ (ревматоидный артрит, системная красная волчанка, полимиозит и др.), инфекционных заболеваний, неопластических процессов, при приёме некоторых лекарственных препаратов (антибиотики группы пенициллина, сульфаниламиды, хинидин, бромиды, хлортиазин, аллопуринол, йод, а также стафилококковый анатоксин, противотифозная вакцина).
Ведущую роль в патогенезе системных васкулитов играют нарушения иммунной системы, развивающиеся на фоне генетически детерминированного иммунодефицитного состояния и действия этиологических факторов (рис..1).
| Этиологический фактор (вирусы, бактерии, микробные токсины, вакцинация, лекарства) |  
| Генетически детерминированные нарушения иммунорегуляции. Маркеры HLA системы. Предпологающие факторы: · переохлаждение; · химические вещества; · радиационные факторы; · стресс |
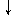 
| ||
| Повреждение эндотелиоцитов, развитие эндотелиальной дисфункции (экспрессия молекул адгезии, рецепторов провоспалительных интерлейкинов), нарушение активности антиоксидантных систем, увеличение продукции провоспалительных цитокинов, хемокинов, экспрессия на клеточных мембранах эндотелиоцитов рецепторов к провоспалительным цитокинам | ||
 
| ||
| Миграция в сосудистую стенку моноцитов, нейтрофилов, лимфоцитов, тучных клеток, формирование дисбаланса Тh1 и Th 2 типов, повышение активности гуморального звена иммунитета с синтезом антител к антигенам сосудистой стенки (АНЦА, АЭКА, аФЛ). Отложение депозитов на базальной мембране сосудов | ||
| Развитие в сосудистой стенке иммуновоспалительного процесса, приводящего к: · некрозу сосудистой стенки; · образованию аневризм; · кровотечению в периваскулярное пространство; · образованию гранулем; · продуктивному процессу с облитерацией просвета сосудов; · тромбозу | ||
 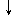
| ||
| Нарушение трофики органов и систем Кровотечение и тромбозы | ||
 
| ||
| Дистрофия и дисфункция органов, полиорганная недостаточность |
Рис. 1 Роль нарушений иммунной системы в патогенезе системных васкулитов
|
|
|
Примечание:АНЦА - антинейтрофильные тела;
АЭКА - антитела к эндотелиальным клеткам;
аФЛ - антитела к фосфолипидам
В основе развития системных васкулитов лежат аутоиммунные процессы, которые характеризуются образованием аутоантител. Под воздействием этиологического фактора происходит повреждение эндотелиоцитов, а также формирование антител к различным аутоантигенам сосудистой стенки. Вероятно, определённую роль в этом играет феномен молекулярной мимикрии, создающий условия для аутоиммунного повреждения не только чужеродных агентов, но и собственных тканей. При этом увеличивается продукция провоспалительных цитокинов, хемокинов, а также экспрессия на эндотелиоцитах молекул адгезии, что ведёт к формированию иммуновоспалительного процесса в сосудистой стенке. При СВ может преобладать активность Т - клеточного (преимущественно за счет Th I типа) или гуморального звеньев иммунной системы (поликлональная гаммапатия, увеличение разных классов иммуноглобулинов, т.е. антител к различным антигенам сосудистой стенки – к эндотелиоцитам, коллагену, эластину, фосфолипидам клеточных мембран, плазменным и перинуклеарным антигенам лейкоцитов. Среди больщого количества аутоантител особое место занимают антинейтрофильные цитоплазматические антитела, взаимодействующие с внутриклеточными аутоантителами. В настоящее время накоплено значительное число фактов, свидетельствующих о том, что АНЦА являются не только возможным маркером системных васкулитов, но и играют важную роль в их патогенезе. Установлено, что цитоплазматические ферменты нейтрофилов при определённых условиях могут экспрессироваться на их мембранах, в результате чего они становятся доступными для АНЦА.
Обсуждаются два принципиальных механизма этого процесса:
1. Мембранная экспрессия цитоплазматических ферментов имеет место в результате предактивации нейтрофилов провоспалительными цитокинами (TNFα, ИЛ-8).
|
|
|
2. Транслокация компонентов первичных гранул на мембране нейтрофилов - это результат не только предактивации нейтрофилов цитокинами, но и ускоренного апоптоза нейтрофилов.
Связывание АНЦА с мембраноассоциированными формами протеиназы 3 (ПР-3) и миелопероксидазы вызывает ряд костимуляционных эффектов, необходимых для развития воспаления. Как было показано, АНЦА способны активировать нейтрофилы на поверхности повреждённых клеток. Следует отметить, что активация нейтрофилов АНЦА зависит не только от специфического распознавания антигена, но и от связывания с определённым типом рецепторов нейтрофилов (Fc-рецепторы), причём, у носителей определённых вариантов этих рецепторов заболевание протекает более тяжело.
В настоящее время в качестве наиболее чувствительного и специфического маркера активации клеточного иммунного ответа выделяют неоптерин (промежуточный метаболит гуанозинтрифосфата). Его молекула имеет небольшую молекулярную массу (253 Д), она биологически стабильна, что делает неоптерин более надёжным для определения в биологических средах, а также для оценки динамики течения васкулита. Функции, выполняемые неоптерином в организме человека, до конца не ясны. Однако многими исследователями было установлено, что под его влиянием in vitro происходит стимуляция продукции TNFα моноцитами, а также образование свободных кислородных радикалов. Оказалось, что оба эти механизма занимают важное место в патогенезе васкулитов. Синтез неоптерина происходит под влиянием γ-интерферона главным образом в макрофагах и моноцитах, но В-лимфоциты и эндотелиоциты также способны его синтезировать. По данным некоторых исследований было показано, что выработка неоптерина стимулируется TNF α и ИЛ-1. Повышенная продукция неоптерина связывается с активацией клеточного звена иммунитета, при этом его уровень имеет прямые корреляционные связи с индексом клинической активности васкулита, что делает его прогностическим маркером течения системных васкулитов.
Взаимодействие аутоантител с антигенами при наличии соответствующего компонента комплемента сопровождается формированием иммунных комплексов, которые фиксируются на базальных мембранах капилляров или сосудистой стенки различных паренхиматозных органов. Это создаёт условия для развития локального воспалительного процесса с тромбозом сосудов и ишемией и некрозом тканей, которые кровоснабжаются этим сосудом.
КЛАССИФИКАЦИЯ
ПРОФИЛАКТИКА
|
|
|
Этиология большинства первичных системных васкулитов не известна, поэтому первичную профилактику этих заболеваний не проводят. Возникновение некоторых форм васкулитов удаётся чётко связать с определёнными причинными факторами, такими, как вирус гепатита В (классический узелковый полиартериит), вирус гепатита С (эссенциальный криоглобулинемический васкулит). В этих случаях профилактические мероприятия направлены на предотвращение инфицированности определённых групп риска (вакцинация против вируса гепатита В).
КЛАССИФИКАЦИЯ
Клинические симптомы васкулитов зависят от типа, размера и локализации поражённых сосудов, а также от активности системного воспаления.
В соответствие с современными классификациям и рекомендациям Международной согласительной конференции в Чапел-Хилле, системные васкулиты подразделяются в зависимости от калибра поражённых сосудов.
Классифицируют системные васкулиты по уровню поражения.
· Преимущественное поражение сосудов мелкого калибра:
· пурпура Шенлейна-Геноха;
· эссенциальный криоглобулинемический васкулит;
· микроскопический полиангиит (полиартериит).
· Преимущественное поражение сосудов мелкого и среднего калибра:
· гранулематоз Вегенера;
· синдром Чарджа-Стросса.
· Преимущественное поражение сосудов среднего калибра:
· узелковый полиартериит;
· болезнь Кавасаки.
· Преимущественное поражение сосудов крупного калибра:
· гигантоклеточный (височный) артериит;
· артериит Такаясу.
· Смешанные состояния (поражение сосудов мелкого, среднего и крупного калибра):
· ББ;
· облитерирующий тромбангиит.
ЭТИОЛОГИЯ
Этиология большинства первичных системных васкулитов неизвестна. Наиболее доказана взаимосвязь возникновения узелкового полиартериита с инфицированием вирусом гепатита В, а эссенциального криоглобулинемического васкулита - с вирусом гепатита С. Обсуждают участие в развитии пурпуры Шенлейна-Геноха стрептококков, стафилококков, парвовируса В19, вируса Эпштейна-Барр, а в развитии болезни Бехчета - вируса простого герпеса. Важную роль в обострении гранулематоза Вегенера играют инфекции St. aureusиPneumocystis jiroveci.
ПАТОГЕНЕЗ
При васкулитах в развитии повреждения сосудов, ишемических нарушений и формировании гранулём одновременно участвует несколько патогенетических механизмов. Определённую роль отводят образованию иммунных комплексов (геморрагический васкулит, криоглобулинемический васкулит, узелковый полиартериит, ассоциированный с инфицированием вирусом гепатита В, синдром Чарджа-Стросса), органонеспецифическим аутоантителам (антитела к эндотелию образуются при болезни Кавасаки), активации клеточного иммунитета, дисбалансу цитокиновой сети (гигантоклеточный артериит, артериит Такаясу, гранулематоз Вегенера, синдром Чарджа-Стросса) и дисфункции эндотелия.
Участие В-клеток в патогенезе васкулитов связано не только с синтезом ими аутоантител, вызывающих деструкцию тканей, но и с продукцией ФНО-α и ИЛ-6, представлением антигена Т-клеткам, формированием гранулёмы и поддержанием иммунологической памяти к аутоантигенам.
При отдельных формах васкулитов превалируют нарушения реологии кровотока (криогло-булинемический васкулит), продукция повреждающих субстанций клетками воспалительного инфильтрата (эозинофилы - синдром Чарджа Стросса; нейтрофилы - гранулематоз Вегенера, микроскопический полиангиит). Под воздействием провоспалительных цитокинов и факторов роста возникает гиперплазия интимы сосуда с облитерацией его просвета (гигантоклеточный артериит, артериит Такаясу).
Важный серологический маркёр и патогенетический медиатор васкулитов мелких сосудов - АНЦА. Это гетерогенная популяция аутоантител, реагирующих с различными ферментами цитоплазмы нейтрофилов, в первую очередь протеиназой-3 и миелопероксидазой, реже с другими цитоплазматическими нейтрофильными ферментами.
Наиболее часто (80-90% случаев) обнаруживают АНЦА при так называемых АНЦА-ассоциированных васкулитах — гранулематозе Вегенера, микроскопическом полиартериите и синдроме Чарджа-Стросса.
В настоящее время накоплен большой фактический материал, свидетельствующий о том, что АНЦА не только служат серологическим маркёром отдельных форм васкулитов, но и играют важную роль в их патогенезе.
Доказательства патогенетической роли АНЦА при васкулитах:
· высокая частота обнаружения АНЦА в сыворотках больных с гранулематозом Вегенера, микроскопическим полиартериитом, синдромом Чарджа-Стросса;
· изменение титров, отражающее активность заболевания (обострение болезни зависит от IgG3-AHЦА, более эффективно активирующих нейтрофилы по сравнению с IgG1 и IgG4-AHЦA);
· активация нейтрофилов и развитие нейтрофильного альвеолита в ранней стадии гранулематоза Вегенера, обнаружение антигенов-мишеней для АНЦА (протеиназа-3, эластаза) в нейтрофильных инфильтратах почечных клубочков;
· отсутствие при иммуногистохимическом исследовании депозитов иммунных комплексов и антител к базальной мембране почечных клубочков в очагах некроза; тяжесть поражения почек зависит от количества активированных нейтрофилов в инфильтратах, причём, уровень активации нейтрофилов коррелирует с титрами АНЦА;
· введение миелопероксидазы-АНЦА лабораторным животным, вызывающее развитие системного некротизирующего васкулита и быстропрогрессирующего гломерулонефрита.
Эффективность иммуносупрессивной терапии, моноклональных антител антиCD20; плазмаферез и внутривенное введение иммуноглобулинов приводят к положительной клинической динамике.
Патогенез АНЦА-ассоциированных васкулитов
Нейтрофилы(предактивация цитокинами и хемокинами)
Нарушение апоптоза и  гибели клеток-→транслокация протеиназы-3 и миелопероксидазы из лизосом на мебрану клеток → связывание с АНЦА → взаимодействие АНЦА с FcyRII и антигенами протеиназы-3 и миелопероксидазы на клеточной мембране примированных ФНО-α нейтрофилов →дегрануляция и окислительный взрыв нейтрофилов.
гибели клеток-→транслокация протеиназы-3 и миелопероксидазы из лизосом на мебрану клеток → связывание с АНЦА → взаимодействие АНЦА с FcyRII и антигенами протеиназы-3 и миелопероксидазы на клеточной мембране примированных ФНО-α нейтрофилов →дегрануляция и окислительный взрыв нейтрофилов.
↑ стимуляции нейтрофилов АНЦА → активация 5-липооксигеназного пути → выработка лейкотриена LTB4 (хемоатрактант для нейтрофилов) → ↑ трансмиграции клеток через эндотелиальный барьер → индукция экспрессии ИЛ-1β и ИЛ-8 в нейтрофилах.
Эндотелий
Индукция экспрессии молекул адгезии (VCAM, ICAM, Е-селектин) на мембране эндотелия → усиление адгезии нейтрофилов к эндотелиальным клеткам.
Увеличение продукции тканевого фактора, тромбомодулина, фактора Виллебранда →развитие микротромбозов, гиперкоагуляции на фоне сосудистого воспаления.
Моноциты
Активация моноцитов → увеличение продукции активных форм кислорода, ИЛ-8.
Действие АНЦА на ПРЗ
→ подавление инактивации ПРЗ естественным ингибитором α1 антитрипсина → образование гранулёмы.
Существует и определённая генетическая предрасположенность к АНЦА-ассоциированным васкулитам. При этом определение эпитопа, индуцирующего иммунный ответ с образованием АНЦА, имеет важное значение для разработки подходов к эпитопспецифической терапии.
Известно несколько генетических факторов, влияющих на продукцию АНЦА.
· Ассоциации с генами HLA:
§ носительство аллеля DR2 у АНЦА-позитивных больных с гранулематозом Вегенера;
§ носительство аллеля DQ7 при транзиторной продукции АНЦА;
§ уменьшение частоты аллелей DR6/DR13 у больных, позитивных по протеиназе-З-АНЦА и миелопероксидазе-АНЦА;
§ увеличение частоты HLA-DR В1*0901 у миелопероксидаза-АНЦА-позитивных больных (в японской популяции).
· Конститутивная экспрессия протеиназы-3 на мембране нейтрофилов и моноцитов при АНЦА-ассоциированных васкулитах.
· Полиморфизм гена Fc-рецептора (Fcг RII и Fcг RIII) на нейтрофилах при гранулематозе Вегенера.
· Полиморфизм аллеля 620W гена PTPN22 внутриклеточной тирозинфосфатазы при гранулематозе Вегенера.
· В-клеточная эпитопная специфичность при АНЦА-ассоциированных васкулитах:
§ протеиназа-З-АНЦА и миелопероксидаза-АНЦА имеют различную эпитопную специфичность;
§ эпитопная специфичность протеиназа-З-АНЦА и миелопероксидаза-АНЦА зависит от активности и тяжести течения патологического процесса;
§ патогенный потенциал АНЦА может быть обусловлен наличием молекуляр-ной мимикрии между эпитопами на протеиназы- З/миелопероксида-зы и микробными антигенами.
КЛИНИЧЕСКАЯ КАРТИНА
Клиническая картина васкулитов отличается разнообразием. Основные клинические синдромы васкулитов следующие:
Конституциональные синдромы (лихорадка, похудение, артралгии, миалгии) характерны для всех форм васкулитов.
Недеструктивный олигоартрит возникает при узелковом полиартериите, гранулематозе Вегенера, синдроме Чарджа-Стросса, пурпуре Шенлейна-Геноха.
Поражение кожи и слизистых оболочек (ливедо, дигитальные инфаркты, язвы, узелки) развивается при узелковом полиартериите, синдроме Чарджа-Стросса, гранулематозе Вегенера.
Пальпируемая пурпура возникает при любой форме васкулита, за исключением гигантоклеточного артериита и артериита Такаясу.
Узловатая эритема и язвы полости рта, половых органов характерны для ВБ.
Множественный мононеврит — патологический процесс при узелковом полиартериите, криоглобулинемическом васкулите, гранулематозе Вегенера, синдроме Чарджа-Стросса, облитерирующем тромбангиите.
Ишемическое поражение почек возникает при узелковом полиартериите, артериите Такаясу.
Гломерулонефрит характерен для микроскопического полиангиита, гранулематоза Вегенера, криоглобулинемического васкулита, синдрома Чарджа-Стросса, пурпуры Шенлейна-Геноха.
Поражение ЛОР органов развивается при гранулематозе Вегенера, реже при микроскопическом полиангиите и синдроме Чарджа-Стросса.
Поражение лёгких чаще встречают при гранулематозе Вегенера, микроскопическом полиартериите, синдроме Чарджа-Стросса, реже при артериите Такаясу, ББ.
Бронхиальная астма или аллергический ринит характерны для синдрома Чарджа-Стросса.
ДИАГНОСТИКА
Общие подходы
Диагностика васкулитов основана на детальном клиническом обследовании, позволяющем уточнить характер поражения внутренних органов и исключить другие заболевания; на оценке клинико-лабораторной активности васкулита, фазы и течения заболевания, степени повреждения органов и систем; на выполнении необходимых для подтверждения диагноза инструментальных, морфологических и лабораторных исследований; на наличии у больного определённых классификационных критериев.
Оценка активности, фазы и течения заболевания, степени повреждения органов — важный подход к оптимизации ведения больных с системными васкулитами. Эту оценку проводят на основании индекса клинической активности васкулита — Birmingham vasculitis activity score (BVAS), адаптированного к больным гранулематозом Вегенера в 2001 г. (BVAS/WEG) и модифицированного в 2003 г. (BVAS, 2003). Все три индекса содержат несколько признаков, разделённых на группы в зависимости от локализации поражения или вовлечения определённой системы органов. Учитывают признаки, обусловленные только васкулитом, присутствующие на момент осмотра, а также возникшие или усугубившиеся в течение последнего месяца до настоящего обследования больного.
В зависимости от активности выделяют несколько фаз заболевания. Чтобы оптимизировать тактику ведения больных, особенно на этапе индукции ремиссии, введён термин «рефрактерное течение васкулита».
Фазы заболевания и характер течения васкулитов:
ü ремиссия — отсутствие признаков активности (общий счёт — 0-1 балл) при нормальном уровне СРБ, на фоне стабильной поддерживающей терапии;
ü ответ на терапию (частичная ремиссия) — уменьшение на фоне лечения общей суммы баллов на 50% от первоначальной;
ü низкая активность (персистирующая активность) — персистенция общих симптомов воспаления (артралгии, миалгии и др.), купируемых незначительным повышением дозы ГК (не требуют эскалации терапии);
ü неактивная фаза — ремиссия, не требующая поддерживающей терапии;
ü «большое» обострение — вовлечение в воспалительный процесс жизненно важных органов или систем (лёгкие, почки, ЦНС, сердечно-сосудистая система), приводящее к увеличению общей суммы баллов на шесть и более и требующее назначения адекватной (эскалационной) терапии циклофосфамидом (как при режиме индукции ремиссии) в сочетании с увеличением дозы ГК до 30 мг/сут, а при необходимости — ПТ метилпреднизолоном, плазмафереза или внутривенного введения иммуноглобулина;
ü «малое» обострение — возврат заболевания с увеличением общей суммы с 0-1 до 5 баллов, требующий увеличения дозы ГК до 30 мг/сут.
Персистенция активности гранулематоза Вегенера (BVAS/WEG) — наличие клинического признака и отсутствие его прогрессирования в течение 28 дней после предыдущего осмотра больного.
Рефрактерное течение АНЦА-васкулитов — увеличение или отсутствие положительной динамики BVAS при остром течении васкулита после 4 нед стандартной терапии, или плохой ответ (<50%) на стандартную терапию BVAS в течение 6 нед лечения, или хроническая персистенция активности (один большой признак и три малых BVAS, BVAS/WG) в течение более 12 нед терапии.
Оценка степени повреждения органов или тканей (индекс васкулитного повреждения — vasculitis damage index).
В отличие от активности, купируемой назначением иммуносупрессивных препаратов, повреждение органов или тканей не поддаётся обратному развитию. При васкулитах под ним понимают наличие у больного необратимых изменений в органах или тканях, развитие которых совпадает с началом воспалительных изменений в сосудистой стенке и обусловлено ими.
Предложенная система оценки представляет собой суммарный счёт по системам или органам, отражающий степень нарушения их функции, вызванного воспалительным процессом в сосудах и/или развившегося на фоне лечения. Индекс кумулятивен. В каждом конкретном случае он может оставаться на прежнем уровне или возрастать, но никогда не уменьшаться. Оценка степени повреждения органов или тканей имеет большое значение для определения прогноза заболевания.
Американской коллегией ревматологов в 1990 г. разработаны классификационные критерии семи форм системных васкулитов. Данные критерии в основном предназначены для эпидемиологических исследований, а не для диагностики васкулитов, особенно в ранних стадиях болезни.
Классификационные критерии узелкового полиартериита:
ü потеря массы тела после начала заболевания на 4 кг и более, не связанная с особенностями питания;
ü сетчатое ливедо — пятнистые, сетчатые изменения рисунка кожи на конечностях и туловище;
ü боль в яичках или их болезненность при пальпации, не связанные с инфекцией, травмой и т.д.;
ü миалгии, слабость или болезненность при пальпации в мышцах нижних конечностей;
ü развитие мононейропатии, множественной мононейропатии или полинейропатии;
ü развитие АГ с уровнем диастолического давления более 90 мм рт.ст.;
ü повышение мочевины крови >40 мг% или креатинина крови >15 мг%, не связанное с дегидратацией или нарушением выделения мочи; инфицирование вирусом гепатита В (наличие HBsAg или антител к вирусу гепатита В в сыворотке крови);
ü артериографические изменения (аневризмы или окклюзии висцеральных артерий), диагностируемые при ангиографии, не связанные с атеросклерозом, фибромышечной дисплазией и другими невоспалительными заболеваниями;
ü гистологические изменения, свидетельствующие о присутствии гранулоцитов в стенке артерий, определяемые при биопсии.
Наличие трёх любых критериев и более позволяет поставить диагноз с чувствительностью 82,2% и специфичностью 86,6%.
Классификационные критерии гранулематоза Вегенера:
ü воспаление носа и полости рта, язвы в полости рта, гнойные или кровянистые выделения из носа;
ü изменения в лёгких при рентгенологическом исследовании (узелки, инфильтраты или полости);
ü микрогематурия (>5 эритроцитов в поле зрения) или скопления эритроцитов в осадке мочи;
ü гранулематозное воспаление в стенке артерии или в периваскулярном и экстраваскулярном пространстве, определяемое при биопсии.
Наличие у больного двух любых критериев и более позволяет поставить диагноз с чувствительностью 88% и специфичностью 92%.
Классификационные критерии синдрома Чарджа-Стросса:
ü астма (затруднение дыхания или диффузные хрипы при вдохе);
ü эозинофилия >10%;
ü аллергия в анамнезе: сезонная аллергия (аллергический ринит) или другие аллергические реакции (пищевая, контактная), за исключением лекарственной; ^ мононейропатия, множественная мононейропатия или полинейропатия по типу перчаток или чулок;
ü мигрирующие или транзиторные лёгочные инфильтраты, выявляемые при рентгенологическом исследовании;
ü синусит (боли или рентгенологические изменения в области околоносовых пазух);
ü скопление эозинофилов во внесосудистом пространстве, определяемое при биопсии.
Наличие у больного четырёх любых критериев и более позволяет поставить диагноз с чувствительностью 85% и специфичностью 99%.
Классификационные критерии пурпуры Шенлейна-Геноха:
ü пальпируемая пурпура (слегка возвышающиеся геморрагические кожные изменения, не связанные с тромбоцитопенией);
ü возраст моложе 20 лет в начале болезни;
ü диффузные боли в животе, усиливающиеся после приёма пищи, или ишемия кишечника (может возникнуть кишечное кровотечение);
ü гистологические изменения в виде гранулоцитарной инфильтрации стенок артериол и венул, определяемой с помощью биопсии.
Наличие у больного двух любых критериев и более позволяет поставить диагноз с чувствительностью 87,1% и специфичностью 87,7%.
Классификационные критерии гигантоклеточного артериита:
ü развитие симптомов заболевания у лиц старше 50 лет;
ü возникновение ранее не отмечавшихся головных болей или изменение их характера и/или локализации;
ü болезненность при пальпации или уменьшение пульсации височных артерий, не связанные с атеросклерозом артерий шеи;
ü увеличение СОЭ >50 мм/ч;
ü васкулит с преимущественно мононуклеарной инфильтрацией или гранулематозным воспалением, обычно с многоядерными гигантскими клетками, определяемый при биопсии стенки артерии.
Наличие трёх любых критериев и более позволяет поставить диагноз с чувствительностью 93,5% и специфичностью 91,2%.
Классификационные критерии артериита Такаясу:
ü начало заболевания в возрасте моложе 40 лет;
ü перемежающаяся хромота нижних конечностей;
ü снижение пульсации на одной или обеих плечевых артериях;
ü разница систолического АД более 10 мм рт.ст. при его измерении на обеих плечевых артериях;
ü наличие шума при аускультации над обеими подключичными артериями или брюшной аортой;
ü изменения при ангиографии: сужение просвета или окклюзия аорты, её крупных ветвей в проксимальных отделах верхних и нижних конечностей, не связанное с атеросклерозом, фибромаскулярной дисплазией и др. (фокальные, сегментарные).
Наличие трёх любых критериев и более позволяет поставить диагноз с чувствительностью 90,5% и специфичностью 97,8%.
При васкулитах для подтверждения диагноза, кроме наличия характерных клинических признаков, как правило, необходимо провести инструментальную, лабораторную диагностику и морфологическое исследование.
Лабораторные исследования
Цель лабораторного исследования — диагностика степени выраженности органной патологии, подтверждение диагноза и дифференциальная диагностика, оценка активности васкулита, эффективности лечения и прогноза заболевания.
Исследование включает ряд показателей.
· Общий анализ крови: нормохромная анемия, тромбоцитоз, нейтрофильный лейкоцитоз, повышение СОЭ. Характерный лабораторный признак синдрома Чарджа-Стросса эозинофилия (более 1,0х10/л у 97% больных), наблюдаемая в любой стадии заболевания.
· Биохимический анализ крови: повышение уровня СРБ, коррелирующее с активностью заболевания. Измерение концентрации креатинина, активности ферментов печени и других биохимических показателей неспецифично и зависит от преобладающего поражения тех или иных оранов и степени нарушения их функций.
· Общий анализ мочи, функциональные пробы почек используют для диагностики патологии и функций почек.
· Бактериологическое исследование крови и бронхоальвеолярный лаваж проводят для исключения инфекции.
· Серологическое исследование осуществляют, чтобы определить наличие маркёров вируса гепатита В и С, ВИЧ (при подозрении на узелковый полиартериит и криоглобулинемический васкулит), а также проводят серологические тесты на сифилис.
Иммунологическое исследование:
· определение АНФ, РФ проводят для исключения системного ревматического заболевания;
· определение АНЦА используют для подтверждения таких диагнозов, как гранулематоз Вегенера, микроскопический полиангиит, синдром ЧарджаСтросса;
· обнаружение криоглобулинов служит для подтверждения диагноза криоглобулинемического васкулита;
· исследование на антитела к фосфолипидам проводят, чтобы исключить первичный антифосфолипидный синдром (при васкулитах могут встречаться аКЛ, но, как правило, в низком, реже в умеренном титре; для васкулитов не характерно обнаружение а|32ГП-1);
· определение аБМК служит для исключения синдрома Гудпасчера (для васкулитов не характерно обнаружение данных аутоантител);
· исследование концентрации компонентов комплемента: её снижение свидетельствует о криоглобулинемическом васкулите.
Клиническое значение исследования АНЦА
Цитоплазматические АНЦА или протеиназа-З-АНЦА с наиболее высокой (80-90% случаев) частотой обнаруживают при гранулематозе Вегенера. При микроскопическом полиартериите и синдроме Чарджа-Стросса преимущественно (60-80% случаев) определяют перинуклеарные АНЦА или миелопероксидазаАНЦА. Определение цитоплазматических АНЦА в качестве скринингового теста позволяет улучшить диагностику гранулематоза Вегенера, особенно в ранней стадии болезни, у больных с лимитированной и атипичной формами заболевания или перекрёстными ангиитными синдромами, а также помогает верифицировать диагноз у некоторых больных с почечной недостаточностью, находящихся на гемодиализе. «Специфичность» цитоплазматических АНЦА для гранулематоза Вегенера колеблется от 88 до 100%, а «чувствительность» зависит от активности, распространённости патологического процесса, формы заболевания и варьирует от 28-50% в «начальной» фазе болезни (поражение только верхних и нижних дыхательных путей в отсутствие признаков васкулита) до 92% у больных с генерализованным васкулитом. IgM-АНЦА часто определяют при лёгочных геморрагиях.
Поскольку гранулематоз Вегенера — очень редкое заболевание, «положительная предсказательная ценность» цитоплазматических АНЦА для диагностики этой патологии очень низкая. Следовательно, определение цитоплазматических АНЦА целесообразно только при очень высокой вероятности развития гранулематоза Вегенера на основании клинических данных и морфологического исследования.
Наличие цитоплазматических АНЦА в сыворотках крови больных с некротизирующими васкулитами на момент изменения им режима терапии (переход после индукции ремиссии циклофосфамидом на поддерживающие дозы азатиоприна) ассоциируется с высоким риском развития обострений.
Персистенция цитоплазматических АНЦА в стадии ремиссии у больных с гранулематозом Вегенера требует более длительного (до 5 лет) применения иммуносупрессивных препаратов.
Инструментальное обследование
Цель инструментального обследования — диагностика органной патологии, подтверждение диагноза и дифференциальная диагностика, оценка активности васкулита и прогноза заболевания.
Ангиография. При узелковом полиартериите её проводят, если невозможно провести биопсию или если получены неспецифические результаты. Исследование показано перед биопсией печени или почек для выявления микроаневризм, которые при биопсии могут привести к кровотечению. При артериите Такаясу, ВБ, облитерирующем тромбангиите ангиография имеет важное значение, поскольку она помогает как подтвердить диагноз, так и оценить динамику и распространение воспалительного процесса, прогноз болезни.
Ультразвуковая допплерография имеет важное значение, когда надо подтвердить диагноз, оценить распространение воспалительного процесса, его активность, прогноз болезни при артериите Такаясу, облитерирующем тромбангиите, болезнях Кавасаки и ББ, а также служит дл
|
|
|


