 |
Равновесие в системе кристалл-раствор
|
|
|
|
КРИСТАЛЛИЗАЦИЯ
Общие сведения
Кристаллы представляют собой однородные твердые тела различной геометрической формы, ограниченные плоскими гранями. Особенностью кристаллов является строго определенное, периодически повторяющееся в трех измерениях расположение ионов, атомов или молекул, образующих кристаллическую решетку.
Кристаллической решеткой определяется форма кристаллов. В зависимости от природы вещества кристаллы могут быть простой (куб, параллелепипед т.д.) или более сложной формы. При массовой кристаллизации реально получаемые кристаллы одного и того же вещества отличаются друг от друга внешним видом. Однако несмотря на это углы между соответствующими гранями во всех кристаллах данного вещества остаются постоянными.
Ряд веществ, обычно химически однотипных, которые имеют подобную кристаллическую решетку, при кристаллизации из растворов выделяются совместно. Они образуют объединенные или смешанные кристаллы переменного состава. Такие вещества называются изоморфными, а явление - изоморфизмом. Типичными представителями таких веществ являются кристаллы КСl и KBr; KH2PO4, KH2AsO4 и NH4H2PO4 и др.
Для некоторых веществ характерно, что в зависимости от термодинамических условий процесса (температуры, давления) одно и тоже вещество образует разные по форме кристаллы. Такое явление называется полиморфизмом и различные формы кристаллов при этом принято обозначать , , и т.д. Так азотнокислый аммоний (NH4NO3) имеет пять полиморфных модификаций.
Кристаллизацией называется процесс выделения из растворов, расплавов и газов твердой фазы в виде кристаллов. В химической технологии наибольшее распространение получила кристаллизация из растворов. Остановимся на рассмотрении кристаллизации из растворов. Получение одновременно большого числа кристаллов в промышленных масштабах называется массовой кристаллизацией. Появление термина массовая кристаллизация связано с теми особенностями, которые присущи массовому одновременному зарождению и росту большого числа кристаллов. Этими особенностями являются: образование большого числа центров кристаллизации, рост кристаллов в условиях конкуренции, соударений, сложных концентрационных и температурных полей, перекристаллизация и т.п. Целью кристаллизации является получение различных веществ в чистом виде, получение кристаллов заданного размера. Процесс кристаллизации используется при производстве минеральных удобрений, соды, химических реактивов, каучуков, резины, фотоэмульсии, полимеров, пластмасс, витаминов, строительных материалов, взрывчатых веществ и т.д.
|
|
|
Одновременное зарождение и рост большого числа кристаллов подчиняется общим законам фазовых превращений и в этом смысле массовая кристаллизация не отличается от роста и зарождения монокристалла. Процесс кристаллизации состоит из следующих стадий: образование пересыщенного раствора, появление зародышей кристаллов, рост кристаллов, промывка и сушка кристаллов. Очередность отдельных стадий может быть различной и протекать они могут последовательно друг за другом или одновременно.
Перекристаллизация заключается в следующем. При низкой пересыщенности раствора или в насыщенном растворе происходит исчезновение мелких и увеличение за счет этого размеров крупных кристаллов, кроме того происходит некоторое изменение формы кристаллов.
Пересыщение приводит к появлению движущей силы процесса кристаллизации. Пересыщенными называются растворы, концентрация которых превышает равновесную концентрацию С* (растворимость) для данных условий. Движущая сила (пересыщение) характеризуется выражением:
|
|
|
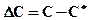 , (К.1)
, (К.1)
где С - концентрация пересыщенного раствора.
Кристаллизация, как всякий массообменный процесс, характеризуется статикой и кинетикой. Статика определяет равновесные характеристики между кристаллами и раствором, т.е. движущую силу процесса. Кинетика определяет скорость протекания процесса, т.е. описывает рост и качество получаемых кристаллов (их размер, фракционный состав, наличие примесей). Проектирование кристаллизационного оборудования строится на основе статических и кинетических характеристик. По балансовым соотношениям определяется общий выход кристаллического продукта, количество тепла, подводимое или отводимое в процессе. Этот расчет строится на основе термодинамических статических характеристиках: растворимости, теплоемкости, теплоте растворения, испарения. Такой расчет позволяет предварительно оптимизировать граничные параметры процесса (химический состав кристаллов, затраты тепла) и выбрать аппаратуру для проведения кристаллизации.
В результате расчета кинетики процесса определяется конкретные размеры аппарата для проведения кристаллизации и фракционный состав получаемых кристаллов.
Равновесие в системе кристалл-раствор
Все твердые вещества, рассматриваемые нами в этом разделе, обладают способностью растворяться в различных жидкостях (растворителях). Растворение твердых веществ в растворителях всегда сопровождается тепловым эффектом: чаще всего поглощением тепла, реже – выделением. Величина и знак теплового эффекта зависят от природы твердого вещества и растворителя, температуры и концентрации раствора. Это тепло называется теплотой растворения. При кристаллизации вещества из раствора так же выделяется или поглощается тепло. Тепловой эффект при этом противоположен по знаку тепловому эффекту при растворении. В практических расчетах величину теплового эффекта при растворении принимают равной величине эффекта при кристаллизации. Сведения о величине и знаке теплового эффекта при растворении приводится в справочной литературе.
Содержание растворенного вещества в растворителе характеризуется концентрацией. Концентрация раствора, при которой наступает подвижное равновесие между кристаллами и раствором, т.е. количество растворяющихся из кристалла частиц (молекул, ионов) и кристаллизирующихся частиц одинаково во времени, называется растворимостью или концентрацией насыщения.
|
|
|
Растворимость различных веществ определяются опытным путем и приводится в справочной литературе. Растворимость различных веществ сильно может отличаться как по величине (кг растворяемого вещества / кг растворителя), так и по зависимости от температуры. Для веществ обладающих "положительной" растворимостью растворимость увеличивается с повышением температуры, а для веществ с "отрицательной" - падает с увеличением температуры.
На рис. (.1) представлена зависимость растворимости некоторых веществ в воде от температуры

Рис.1. Кривые растворимости в воде (KNO3; NaCl; KCl; Na2SO4; Na2SO4*10H2O)
Растворимость веществ в различных растворителях зависит от физико-химических свойств как самих веществ, так и растворителя и от температуры. Наибольшее распространение в промышленности в качестве растворителя нашла вода для неорганических веществ, а для органических - спирты, эфиры, углеводороды, хлорпроизводные и другие органические жидкости.
Растворимость определяет условия равновесия между кристаллами и раствором. Равновесие можно представить в виде диаграмм в координатах температура-состав (Рис. 2).

Рис..2. Диаграмма растворимости системы NH4Cl-H2O
На этой диаграмме линия СF соответствует насыщенным растворам соли (линия растворимости), СD - растворам, находящимся в равновесии со льдом (вода в кристаллическом состоянии). В точке С, называющейся криогидратной, существует три фазы: раствор, кристаллы соли и лед. Область СFЕ ограничивает область пересыщенных растворов, т.е. растворов в которых концентрация выше растворимости. При некоторых условиях, рассматриваемых ниже, концентрация растворенного вещества может быть больше его растворимости. Такие растворы называются пересыщенными. Область CFE называется полем кристаллизации соли и определяет пересыщенные растворы и механические смеси насыщенного раствора и избытка кристаллической соли.
|
|
|
Точки на диаграмме, расположенные выше линии DС и СF показывают состав ненасыщенных растворов.
Область ВСD называется полем кристаллизации льда, а точки в этой области характеризуют механическую смесь раствора с избытком льда.
Ниже линии ВСЕ находятся точки, отражающие состав твердой фазы, состоящей из кристаллов NH4Cl и льда (жидкая фаза отсутствует).
Диаграммы состава системы (Рис. 2) позволяют графически проводить расчеты процессов изотермического испарения растворов и кристаллизации при охлаждении.
|
|
|


