 |
Глава 2.5. Энергетика мышечного сокращения
|
|
|
|
Непосредственным источником энергии для сокращения мышц служит реакция распада АТP:
АТР ® АDР + Pi.
Однако содержание АТР в мышцах мало - всего 2-4 ммоль. Этого достаточно только для обеспечения энергией всего лишь восьми одиночных сокращений. Поэтому в организме необходим постоянный ресинтез АТР. Добиться этого можно несколькими путями в кислородных и бескислородных условиях.
Наиболее быстрый путь регенерации АТР за счет фосфорилирования АDР в креатинкиназной реакции, когда содержащийся в мышцах креатинфосфат может передать свою фосфатную группу со всем запасом энергии ее связи на АDP:
Креатинфосфат + АDP ® Креатин + АТP.
Благодаря процессу фосфорилирования, который катализируется креатинфосфокиназой, запасы АТР в мышце постоянно пополняются. За счет расщепления креатинфосфата энергией обеспечивается максимально интенсивная работа, длительность которой не более 5-6 с. Этот же способ энергообеспечения используется в начале любой деятельности. Однако через 10-12 с работы мышцы возникает необходимость в пополнении уже резервов креатинфосфата. Пополнение осуществляется за счет окисления жирных кислот и гликогена. При этом образуется АТР, используемый для ресинтеза креатинфосфата из креатина. Креатинкиназный путь максимально эффективен. Он не дает никаких побочных продуктов и не требует никаких дополнительных затрат, а запущен может быть моментально. Основной минус этого источника АТР в том, что его хватает ненадолго.
Следующим путем ресинтеза АТР является гликолиз, т. е. анаэробное окисление глюкозы до молочной кислоты. Исходным субстратом гликолиза является глюкоза, приносимая к мышцам кровью, или содержащийся в мышце гликоген. Запасы глюкозы в организме в виде гликогена достаточно велики: до 2 % в мышцах и до 6 % в печени от их массы. За счет расщепления гликогена энергией обеспечивается менее интенсивная работа, которая может продолжаться от 20 с до 4-5 мин, а также начало любой деятельности.
|
|
|
Гликолиз хорош тем, что не требует повышенного снабжения организма кислородом и обладает большим резервом, чем креатинкиназный путь ресинтеза АТР. Но он малоэффективен. Запасы гликогена в организме небезграничны и легко могут быть исчерпаны. Гликолиз способствует накоплению недоокисленных продуктов распада глюкозы, в том числе молочной кислоты, концентрация которой в мышцах и крови, куда она переходит из мышц, может возрастать в несколько раз, что изменяет уровень pH клеток в кислую сторону и существенно сказывается на деятельности клеточных структур. «Запуск» гликолиза требует некоторого времени. Он не настолько быстр, как креатинкиназная реакция, и полное его развертывание происходит в течение 10-20 с.
Главный путь регенерации АТР представляет собой процесс дыхательного фосфорилирования. В этом случае окислению могут подвергаться самые различные соединения: углеводы, образовавшиеся при гидролизе жиров жирные кислоты и глицерин, продукты расщепления белков – аминокислоты, причем белки, ценные для организма вещества, расщепляются лишь при чрезмерно выраженном утомлении, болезни и голодании.
Процесс аэробного окисления намного сложнее и многоэтапнее гликолиза. Зато возможности аэробного синтеза АТР почти безграничны, так как субстраты окисления практически неисчерпаемы. За счет кислородного расщепления веществ энергией обеспечивается малоинтенсивная работа, но такая деятельность может продолжаться долго (до нескольких часов).
Дыхательное фосфорилирование является высокоэффективным процессом и дает большое количество молекул АТР. Конечные продукты этого процесса – вода и углекислота – безвредны, избыток углекислоты легко удаляется через легкие с выдыхаемым воздухом. Круг возможных субстратов окисления велик и разнообразен. Однако этот путь синтеза АТР требует повышенного снабжения организма кислородом, что в практической жизни не всегда может быть в должной мере осуществлено. Недостатком является также чрезвычайная длительность дыхательного фосфорилирования, поэтому он не может использоваться в начале работы или в случаях, когда деятельность достаточно интенсивна и требует высокой скорости высвобождения энергии.
|
|
|
Существует определенная последовательность включения и преобладания различных путей ресинтеза АТР для обеспечения мышечной деятельности: первые 2-3 с расщепляется только АТР; затем начинается ее ресинтез - от 3 до 20 с – преимущественно за счет креатинфосфата; через 30-40 с максимальной интенсивности достигает гликолиз; в дальнейшем постепенно все больше превалирует аэробное окисление. Наконец в безвыходных ситуациях включается последний, самый невыгодный для организма путь ресинтеза АТР - миокиназный:
2 АDР ® АТР + АМР.
При всякой мышечной деятельности повышается поглощение кислорода, и чем сокращение интенсивнее, тем кислорода требуется больше. Например, при ходьбе со скоростью 4 км/ч по ровной дороге потребность в кислороде (по сравнению с состоянием покоя) возрастает в 4 раза, при ходьбе со скоростью 8 км/ч – в 10 раз, а при спортивном беге на короткие и средние дистанции – в 30-50 раз. Сокращающиеся мышцы нуждаются в повышенном поступлении из крови кислорода и питательных веществ и удалении продуктов распада. Питательные вещества, распадаясь, обеспечивают энергию для мышечного сокращения, а кислород участвует в этом распаде. Чтобы обеспечить повышенную доставку кислорода и питательных веществ, а также скорейшее удаление продуктов распада, в работающих мышцах увеличивается скорость тока крови и расширяются кровеносные сосуды. Концентрация продуктов распада в клетке является одним из регуляторов интенсивности мышечного сокращения. При увеличении концентрации интенсивность сокращения снижается, а по достижении определенного уровня сокращение становится невозможным. Таким образом, клетка предохраняет себя от выполнения чрезмерной работы. На рис. 2.25 суммированы все возможные источники, обеспечивающие энергией сократительную деятельность.
|
|
|

Рис. 2.25. Источники энергии для сокращения мышц
Для мышечной деятельности существуют этапы сокращения, расслабления и отдыха. В момент отдыха регенерируются креатинфосфат, гликоген, фосфолипиды, мышечные белки и АТР, в результате чего в мышце устанавливаются дорабочие соотношения ее химических ингредиентов.
Волокна скелетной мускулатуры могут быть классифицированы по принципу быстрого или медленного сокращения, основанного на их сократительных и метаболических свойствах. Различают два типа мышечных волокон.
Медленные мышечные волокна (волокна первого типа) расположены в глубоких слоях мышц конечностей. Они красного цвета, так как в них присутствует миоглобин и цитохромовые пигменты. Клетки медленных мышечных волокон содержат много митохондрий с высокой активностью окислительных ферментов, а саркоплазматический ретикулум развит слабо, содержание гликогена невелико. Сила их сокращений сравнительно небольшая, а скорость потребления энергии такова, что им хватает аэробного метаболизма. Они участвуют в движениях, не требующих значительных усилий, например, в поддержании позы. Мембрана медленных волокон не обладает электрической возбудимостью, каждый импульс приводит к высвобождению лишь небольшого количества ацетилхолина. Степень деполяризации мембраны зависит от частоты стимуляции. В ответ на стимуляцию наблюдается медленное сокращение и медленное расслабление. Источником АТР в медленных волокнах является аэробное дыхание. Многие волокна при недостатке кислорода продолжают работать за счет анаэробного гликолиза, в этом случае образуется молочная кислота. По мере окисления дыхательного субстрата мобилизуются резервные углеводы и жиры. Тепло отводится от мышцы по мере его выработки. Медленные волокна обеспечивают длительное сокращение мышцы.
|
|
|
Быстрые мышечные волокна (волокна второго типа) располагаются в поверхностных слоях мышц конечностей. Их клетки белого цвета, так как миоглобина и цитохромовых пигментов мало или нет совсем. Клетки быстрых мышечных волокон содержат мало мито- хондрий, саркоплазматический ретикулум хорошо развит, имеется множество гликогеновых гранул. Мембрана обладает электрической возбудимостью. Наблюдается быстрое сокращение (в 3 раза быстрее, чем у медленных волокон) и довольно быстрое утомление.
Источником АТР служат анаэробные процессы (гликолиз). В качестве дыхательного субстрата интенсивно используется гликоген. Тепло поглощается волокнами, так как кровеносная система не обеспечивает его быстрого отвода. Мышца некоторое время сокращается даже тогда, когда кровеносная система не успевает обеспечить дополнительную доставку кислорода. Этим мышечным волокнам присуща значительная сила сокращения, поэтому двигательные единицы, состоящие из белых мышечных волокон, обеспечивают быстрые, но кратковременные движения, требующие рывковых усилий.
Саркоплазма скелетных мышц содержит большие запасы гликогена, локализованного в гранулах, расположенных вблизи I-диска. Гликоген мышц в результате реакции фосфоролиза гидролизуется под действием мышечного фермента гликогенфосфорилазы до глюкозо-1-фосфата, изомеризация которого с помощью фосфоглюкомутазы дает глюкозо-6-фосфат. Гликогенфосфорилаза контролируется сложной серией реакций, включающей как аллостерические механизмы, так и ковалентную модификацию фермента путем фосфорилирования-дефосфорилирования (рис. 2.26).

Рис. 2.26. Регуляция распада и синтеза гликогена (согласно [12])
Мышечная гликогенфосфорилаза существует в двух формах: фосфорилаза a (фосфорилированная по одному из остатков серина, активность которой не зависит от сАМР) и фосфорилаза b (дефосфорилированная, активная только в присутствии сАМР). Фосфорилаза а представляет собой димер, содержащий в качестве простетической группы пиридоксальфосфат. В мышце фосфорилаза активируется адреналином опосредованно через образование сАМР. Адреналин, взаимодействуя с b-адренергическими рецепторами, расположенными в клеточной мембране, активирует аденилатциклазу, находящуюся на внутренней поверхности клеточной мембраны и катализирующую синтез сАМР из АТР. сАМР является активатором сАМР-зависимой протеинкиназы (протеинкиназы А), катализирующей фосфорилирование неактивной киназы фосфорилазы. Активная форма последнего фермента в свою очередь фосфорилирует фосфорилазу b, переводя ее в фосфорилазу а. Активации фосфорилазы способствует также увеличение концентрации ионов Са2+, сигнала, инициирующего мышечное сокращение. Киназа фосфорилазы имеет структуру (abgd)4. сАМР-зависимая протеинкиназа фосфорилирует остатки серина в субъединицах a и b. b-Субъединица идентична рассмотренному выше кальмодулину и связывает 4 иона Са2+, что приводит к активации каталитической g-субъединицы, хотя вся молекула остается в дефосфорилированной b -конфигурации. Максимальная активность фосфорилазы а проявляется также только в присутствии ионов Са2+.
|
|
|
Фосфорилаза а и киназа фосфорилазы а дефосфорилируются и ингибируются протеинфосфатазой-1, которая становится активной после фосфорилирования сАМР-зависимой протеинкиназой ингибитора-1. Его дефосфорилированная форма блокирует активный центр протеинфосфатазы-1. Таким образом, сАМР контролирует как активацию, так и инактивацию фосфорилазы.

3-метилгистидин
Как уже говорилось, источником энергии для мышечного сокращения может быть распад не только углеводов и жиров, но и мышечных белков. Поскольку аминокислоты, образовавшиеся при распаде мышечного белка, могут реутилизовываться для синтеза других белков в клетке или переноситься к другим органам и там вступать в обменные процессы, это создает препятствие при изучении использования энергии распада белков для обеспечения мышечного сокращения. Однако актин и миозин содержат посттрансляционно-модифицированную аминокислоту 3-метилгистидин, встречающуюся только в мышечных белках. Обнаружение этой аминокислоты в моче служит показателем скорости распада мышечных белков.
В активно работающих мышцах при недостаточном снабжении кислородом АТР синтезируется в результате анаэробного гликолиза за счет процесса превращений глюкозо-6-фосфата в пируват, который с помощью лактатдегидрогеназы и NАDН восстанавливается до лактата. Лактат переносится кровью в печень, где в процессе глюконеогенеза через промежуточное образование пирувата (в печени отношение NADН / NАD+ ниже, чем в сокращающейся мышце, и лактатдегидрогеназная реакция протекает в сторону окисления лактата) и оксалоацетата превращается в глюкозо-6-фосфат. Глюкозо-6-фосфат с током крови снова может вернуться в мышцу, где будет использован для ресинтеза мышечного гликогена. Этот циклический процесс назван в честь открывших его исследователей циклом Кори, или глюкозо-лактатным циклом (рис. 2.27). Цикл Кори обеспечивает утилизацию лактата, предотвращает его накопление и связанное с этим понижение рН в мышце.
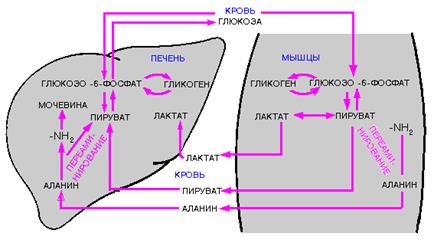
Рис. 2.27. Цикл Кори и цикл аланина (согласно [12])
Подобная циклу Кори связь существует в глюкозо-аланиновом цикле, берущем начало с протеолиза мышечных белков. Образующиеся аминокислоты в результате трансаминирования в присутствии ферментов (аминотрансфераз) и пиридоксальфосфата в качестве кофермента превращаются в α-кетокислоты. В реакции, катализируемой аланинтрансаминазой, аминогруппы из разных аминокислот переносятся на пируват, конечный продукт анаэробного гликолиза. Образующийся аланинпоступает в кровь и переносится в печень, где в реакции трансаминирования снова преобразуется в пируват, который частично окисляется, а частично включается в глюконеогенез. Цикл аланина служит каналом передачи азота и предшественников глюкозы в печень, где происходит у человека синтез конечных продуктов азотистого обмена, а именно мочевины.
При интенсивном анаэробном гликолизе рН мышечной клетки может понизиться настолько, что сокращение станет невозможным. Этого не происходит благодаря быстрому выходу кислых метаболитов (лактата и пирувата) из мышечной клетки в кровь.
Давно известно, что в работающей мышце образуется аммиак. Его непосредственным источником является цикл АМР-IMP. При дезаминировании АМР с образованием IMP под действием аденилатдезаминазы выделяется аммиак:
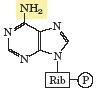
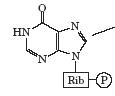
AMP + H2O ® IMP + NH3.
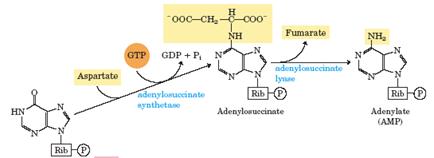
IMP может снова превратиться в АМР в ходе реакций, использующих аспартат через стадию образования промежуточного соединения - аденилосукцината. Образование аденилосукцината катализируется аденилосукцинатсинтетазой и требует участия в реакции GTP. Удаление части аспарагиновой кислоты в виде фумарата катализируется ферментом аденилосукциназой (аденилосукцинатлиазой) и приводит к образованию АМР.
IMP + GTP + аспартат ® аденилосукцинат + GDP + Pi,
Аденилосукцинат ® AMP + фумарат
2.5.1. Синтез креатинфосфата. Одним из соединений, регенерирующих необходимый для сокращения мышц АТР, является креатинфосфат, который образуется при фосфорилировании креатина.
почки кровь печень
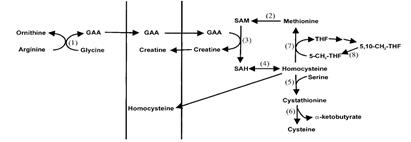
Рис. 2.28. Схема синтеза креатина: GAA - гуанидинацетат, SAM - S -аденозилметионин, SAH - S -аденозилгомоцистеин, THF - тетрагидрофолиевая кислота (согласно [19])
Синтез креатина происходит в почках и печени в две стадии с участием следующих аминокислот: аргинина, глицина и метионина. Общая схема синтеза креатина представлена на рис. 2.28. В почках из аргинина и глицина при действии глицинамидинотрансферазы образуется гуанидинацетат:
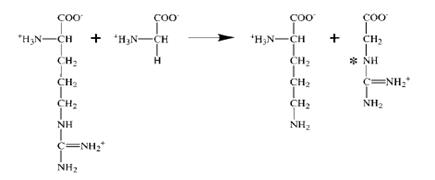
аргинин глицин орнитин гуанидинацетат.
Гуанидинацетат транспортируется в печень, где происходит его метилирование с помощью S -аденозилметионина (SAM), образующегося при действии АТР на метионин:
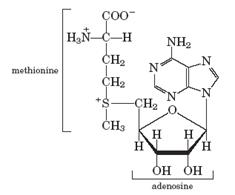
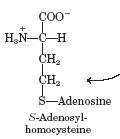
S -аденозилметионин (SAM) S -аденозилгомоцистеин (SAH).
Эту реакцию катализирует гуанидинацетатметилтрансфераза (GAMT):
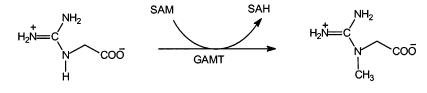
гуанидиноацетат креатин
Механизм реакции метилирования, катализируемый GAMT, представлен на рис. 2.29, из которого видно, что оттягивание протона от NH-группы гуанидинацетата анионом Tyr221 способствует атаке электронной парой атома азота гуанидинацетата углеродного атома метильной группы SAM с образованием креатина и S -аденозилгомо-цистеина (SAH).
Образовавшийся креатин с кровью переносится в мышцы и клетки мозга, где из него под действием креатинкиназы и АТР синтезируется креатинфосфат (реакция легко обратима). Фермент локализуется в цитоплазме и митохондриях клеток, обладает органоспецифичностью.

Рис. 2.29. Механизм реакции метилирования гуанидинацетата с помощью S -аденозилметионина (SAM), катализируемой гуанидинацетатметилтрансферазой (GAMT) (согласно [19])
В работающей мышце креатинфосфат расходуется на регенерацию АТР из ADP, в покоящейся мышце, наоборот, энергия запасается в виде креатинфосфата, синтезируемого в митохондриях мышечных клеток из креатина и АТР. В результате неферментативного дефосфорилирования кретинфосфат превращается в креатинин, представляющий собой внутренний амид креатина, не используемый организмом и выводимый с мочой.
Определение содержания креатина в крови и моче и измерение активности креатинкиназы используется для характеристики интенсивности работы мышц в спортивной медицине и при некоторых патологических состояниях для диагностики инфаркта миокарда, мышечных дистрофий и т. д.
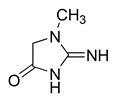
креатинин
2.5.2. Гистидиновые дипептиды. В мышцах и головном мозге были обнаружены гистидиновые дипептиды: карнозин (b-аланил- гистидин), гомокарнозин и ансерин (N -метилкарнозин или b-аланил- метилгистидин), содержание которых особенно велико в скелетных мышцах.

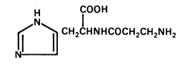
ансерин карнозин

гомокарнозин
Карнозин образуется из гистидина и b-аланина под действием карнозинсинтетазы. Промежуточным продуктом реакции является b-аланиладенилат:
АТР + Гистидин + b-Аланин ® АМР + РРi + Карнозин.
b-Аланин получается при катаболизме пиримидиновых нуклеотидов (цитозина и урацила). Реакция метилирования карнозина с помощью SAM, катализируемая N -метилтрансферазой, дает ансерин:
S -аденозилметионин + Карнозин ®
S -аденозилгомоцистеин + Ансерин.
Гомокарнозин (g-аминобутирилгистидин), структурно и метаболически близкий к карнозину, также обнаруживается в центральной нервной системе, хотя физиологическая роль его не ясна. Биосинтез гомокарнозина из аминобутирата и гистидина в мозгу человека катализирует карнозинсинтетаза.
Zn-содержащая карнозингидролаза (карнозиназа), расщепляющая карнозин с образованием b-аланина и гистидина, не гидролизует гомокарнозин.
Карнозин может выходить из мышц в кровь и поглощаться почками и энтероцитами. Карнозин стимулирует АТР-азную активность миозина, активирует работу ионных насосов мышечных клеток, увеличивает амплитуду сокращения скелетных мышц. В мышцах человека ансерин отсутствует. Его обнаруживают лишь у видов, мышцы которых способны к быстрому сокращению (мышцы конечностей кролика, грудная мышца голубя). Кроме того, гистидиновые дипептиды поддерживают буферную емкость быстрых мышц и не способствуют накоплению лактата, который в их отсутствие приводит к ацидозу. Гистидиновые дипептиды аккумулируют метаболически важные продукты, образующиеся и результате деградации нуклеиновых кислот и нуклеотидных коферментов.
Оба дипептида образуют хелатные комплексы с ионом меди и способствуют усвоению данного металла. Возможно, они участвуют в патологическом процессе при болезни Вильсона. Карнозин и ансерин, проявляя антиоксидантную активность, защищают липидные мембраны мышечных и мозговых клеток, содержащие небольшое количество витаминов Е и А, от действия активных форм кислорода и замедляют процессы старения человека, влияя на скорость апоптоза. Карнозин и ансерин усиливают эффект жирорастворимых антиоксидантов, таких, например, как α-токоферол. Недавно было установлено, что карнозин обладает супероксиддисмутазной активностью и является регулятором активности липоксигеназы.
Библиографический список
1. Биохимия / Под ред. Е. С. Северина. М.: Гэотар-Мед, 2007.
2. Гусев Н. Б. Молекулярные механизмы мышечного сокраще-
ния // Соросовский образовательный журнал. 2000. Т. 6. С. 24-32.
3. Клячко Н. Л. Биологическая подвижность и полимеризация актина // Соросовский образовательный журнал. 2000. Т. 6. С. 5-9.
4. Марри Р., Греннер Д., Мейес П., Родуэл В. Биохимия человека. М.: Мир, 2004. Т. 1-2.
5. Овчинников Ю. А. Биоорганическая химия. М.: Просвещение, 1987.
6. Страйер Л. Биохимия. М.: Мир, 1984. Т. 1-3.
7. Bloom W., Fawcett W. A. Textbook of histology. Philadelphia: W. B. Saunders Company, 1968.
8. Farah C. S., Reinach F. C. The troponin complex and regulation of muscle contraction // FASEB J. 1995. V. 9. P. 755-767.
9. Gordon A. M., Homsher E., Regnier M. Regulation of contraction in striated muscle // Physiol. Rev. 2000. V. 80. P. 853-924.
10. Houdusse A., Love M. L., Dominguez R., Grabarek Z., Cohen C. Structures of four Ca2+-bound troponin C at 2.0 Ao resolution: further insights into the Ca2+-switch in the calmodulin superfamily // Structure. 1997. V. 5. P. 1695-1711.
11. http: // www. химик. ru/encyclopedia
12. http: // humbio.ru/humbio/cytology
13. Kabsch W., Mannherz H. G., Suck D., Pai E. F., Holmes K.C. Atomic structure of the actin: DNase I complex // Nature. 1990. V. 347. P. 37-44.
14. Malnic B., Farah C. S., Reinach F. C. Regulatory properties of the NH2- and COOH-terminal domains of troponin T // J. Biol. Chem. 1998. V. 273. P. 10594-10601.
15. Nelson D. L., Cox M. M. Lehninger Principles of Biochemistry. 4th e. New York: W. H. Freeman, 2004.
16. Perry S. V. Troponin T: genetics, properties and function // J. Muscle Res. Cell Motility. 1998. V. 19. P. 575-602.
17. Rao S. T., Wu S., Satyshur K. A., Ling K. Y., Kung C., Sundaralinggam M. Structure of Paramecium tetraurelia calmodulin at 1.8 Ao resolution // Protein Sci. 1993. V. 2. P. 436-447.
18. Satyshur K. A., Rao S. T., Pyzalska D., Drendel W., Greaser M., Sundaralinggam M. Refined structure of chicken skeletal muscle troponin C in the two-calcium state at 2 Ao resolution // J. Biol. Chem. 1998. V. 263. P. 1628-1647.
19. Stead L. M., Au K. P., Jacobs R. L., Brosnan M. E., Brosnan J. T. Methylation demand and homocysteine metabolism: effects of dietary provision of creatine and guanidinoacetate // Am. J. Physiol. Endocrinol. Metab. 2001. V. 281. P. E1095- E1100.
20. Takeda S., Yamashita A., Maeda K., Maeda Y. Structure of the core domain of human cardiac troponin in the Ca2+-saturated form // Nature. 2003. V. 424. P. 35-41.
21. Tung C.-S., Wall M. E., Gallagher S. C., Trewhella J. A model of troponin-I in complex with troponin-C using hybrid experimental data: The inhibitory region is a b-hairpin // Protein Sci. 2000. V. 9. P. 1312- 1326.
22. Van Lierop J. E., Wilson D. P., Davis J. P., Tikunova S., Sutherland C., Walsh M. P., Johnson J. D. Activation of smooth muscle myosin light chain kinase by calmodulin. Role of Lys30 and Gly40 // J. Biol. Chem. 2002. V. 277. P. 6550-6558.
|
|
|


